ДЕДИФФЕРЕНЦИРОВКА КАК ОСНОВА КАЛЛУСОГЕНЕЗА
Культура изолированных тканей обычно представлена каллусными и гораздо реже опухолевыми тканями. Каллусная ткань образуется в результате повреждения на целых растениях, а также в стерильной культуре на эксплантах — фрагментах ткани или органа, используемых для получения первичного каллуса. Возникновение каллуса связано с неорганизованным делением (пролиферацией) дедифференцированных клеток. Дедифференцировка — основа создания каллусной ткани. В процессе дифференцировки клетки теряют способность делиться. Дедифференцировка — это возвращение клеток в меристематическое состояние, при котором они сохраняют способность к делению. У интактных растений дедифференцировка и индукция каллусогенеза возникают вследствие образования раневых гормонов (травматиновая кислота) при механическом повреждении. Обязательное условие дедифференцировки тканей экспланта и превращения их в каллусные клетки, помимо повреждения, — присутствие ауксинов и цитокининов. Среди ауксинов чаще всего используют 2,4-D (2,4-дихлорфенок-сиуксусную кислоту), ИУК (индолил-3-уксусную кислоту), НУК (а-нафтилуксусную кислоту), причем наибольшую активность проявляет 2,4-D. Из цитокининов в искусственные питательные среды обычно вносят кинетин, 6-БАП (6-бензиламинопурин), зеатин. Наиболее активны 6-БАП и зеатин. Функции этих двух групп гормонов в каллусогенезе разные, но они тесно связаны между собой. Ауксины вызывают процессы дедифференцировки клетки, подготавливают ее к делению. Затем цитокинины инициируют деление клеток. Последние исследования свидетельствуют, что ауксины индуцируют синтез главной протеинкиназы клеточного деления Рз4сас2, а цитокинины — циклинов. Таким образом, действие этих гормонов проявляется только при последовательном или одновременном внесении их в среду. Кроме того, оно будет зависеть от физиологического состояния клеток экспланта, от их компетентности к действию тех или иных внешних факторов. Результаты исследований показали, что полисахариды и какие-то неизвестные индукторы тоже могут вызывать деление клеток, приводящее к образованию каллуса.
Во время процесса дедифференциации, который у всех клеток сходен, клетки должны утратить характерные черты исходной ткани. В первую очередь они теряют запасные вещества — крахмал, белки, липиды. В них разрушаются специализированные клеточные органеллы, в частности хлоропласта, но возрастает число амилопластов. Кроме того, разрушается аппарат Гольджи, перестраиваются эндоплазматический ретикулюм и элементы цитоскелета.
Через несколько часов после перенесения экспланта в условия in vitro начинается новый синтез белка. Он связан, вероятно, с механическим повреждением и действием гормонов, сохранившихся в экспланте с момента его изоляции из растения. Когда данные гормоны израсходуются, синтез белка прекращается. Если в это время клетки будут культивироваться на питательной среде, содержащей ауксины и цитокинины, то начнется каллусогенез, т.е. в результате дедифференцировки и деления клеток будет
образовываться первичный каллус. Таким образом, специализированная клетка растительной ткани становится каллусной в результате дедифференцировки, т.е. восстановления у нее способности к делению.
ТИПЫ КУЛЬТУР КЛЕТОК И ТКАНЕЙ
В зависимости от способа, условий культивирования и происхождения можно выделить несколько типов культур клеток и тканей. Если культивирование происходит поверхностно на агаризованной питательной среде, то образуется каллусная ткань. Она не имеет четко выраженной структуры, но может различаться по плотности. Происхождение и условия выращивания определят, будет ли каллусная ткань рыхлой, средней плотности или плотной. Рыхлая каллусная ткань имеет сильно оводненные клетки, легко распадается на небольшие группы клеток и кластеры и поэтому может быть использована для получения суспензионной культуры. Ткань средней плотности характеризуется хорошо выраженными меристематическими очагами. В ней легко инициируются процессы органогенеза. Наконец, у плотных каллусных тканей различают зоны редуцированного камбия и трахеидоподобных элементов:
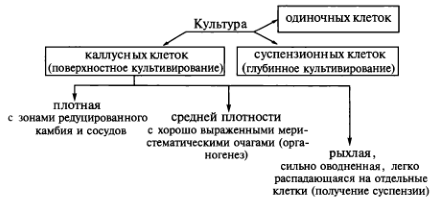
Существует также суспензионная культура клеток, которую выращивают в жидкой питательной среде, так называемое глубинное культивирование. Клеточные суспензии образуются как из каллусных тканей, так и непосредственно из экспланта. Для получения суспензионных культур предпочтительнее брать каллусы рыхлого типа. Если для этой цели необходимо использовать плотный каллус, то его можно разрыхлить, исключив из питательной среды соли Са2+. С этой же целью можно культивировать ткань на среде, содержащей ауксин 2,4-D или ферменты — пектиназу (0,2 мг/л) и целлюлазу (0,01 мг/л). Наилучший эффект достигается при добавлении ферментов. Суспензионные культуры клеток можно получить и непосредственно из экспланта по методу Ф. Стюарда. Для этого эксплант помещают в жидкую среду при постоянном автоматическом перемешивании. Дедифференцированные клетки отрываются от экспланта, образуя суспензию в питательной среде. Постоянное встряхивание — необходимое условие культивирования клеточных суспензий. Суспензионные клетки делятся в присутствии тех же двух групп гормонов (ауксинов и цитокининов), которые индуцируют деление клеток в каллусных тканях. Следовательно, можно сказать, что суспензионные культуры представлены разными агрегатами каллусных клеток.
Клеточные суспензии играют значительную роль в биотехнологии. Они могут быть использованы для получения изолированных протопластов, которые применяют для клеточной селекции, при введении чужеродных ДНК и других процессах. Клеточные суспензии культивируют в больших количествах для получения вторичных метаболитов, выявления новых веществ, для выращивания клеточной биомассы. Однако увеличение клеточной биомассы в результате деления клеток и синтез вторичных метаболитов разобщены во времени. Поэтому необходимо хорошо знать физиологию, свойства клеток в суспензионных культурах, чтобы получить максимальный выход продукта. Состояние клеточных суспензий характеризуется плотностью клеточной популяции. За 14 —16 дней (средняя длительность пассажа) плотность обычно повышается от 5-104 до 5-106 кл/мл. Качество суспензии определяется степенью агрегированности. Агрегаты должны содержать не более 10 — 12 клеток.
Большой интерес представляет культура одиночных клеток. Ее применяют в клеточной селекции для отбора гибридных клеток и их клонирования, а также для генетических и физиологических исследований. Например, вопрос о причинах генетической неоднородности легче решать, используя клон-потомство одной клетки, а не гетерогенную ткань исходного экспланта.
Однако культивирование одной или нескольких клеток связано с определенными трудностями, состоящими в том, что одиночная клетка живет, но не делится в тех условиях, которые разработаны для нормального роста и размножения клеток каллусной ткани. Поэтому при культивировании одиночных клеток потребовалась выработка специальных методов. Все они основаны на использовании так называемого «кондиционирующего фактора» — метаболитов, выделяемых в среду делящимися клетками. Когда на питательную среду высаживается одна клетка или небольшое их количество, они не делятся, так как выделяемого кондиционирующего фактора не хватает для индукции деления. Следовательно, необходимо повысить концентрацию фактора в питательной среде. Этой цели служат следующие методы:
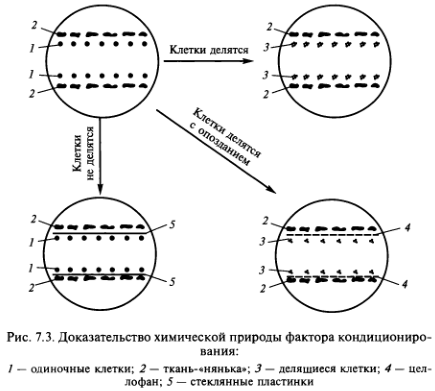
- Метод ткани-«няньки» — кондиционирующий фактор выделяется находящимися рядом с одиночной клеткой кусочками ткани-«няньки» (рис. 7.1).
- Метод «кормящего слоя» — кондиционирующий фактор выделяют активно делящиеся клетки суспензионной культуры того же вида растений, что и одиночная клетка (рис. 7.2).
- Кондиционирование среды — осуществляется путем добавления в нее питательной среды, отфильтрованной от интенсивно делящихся клеток.
- Метод культивирования одиночных клеток — осуществляется в микрокапле, т.е. в очень малом объеме («20 мкл) богатой питательной среды (Ю.Ю.Глеба).

Точно сказать, что представляет собой кондиционирующий фактор, пока невозможно. Согласно исследованиям А.И.Павловой и Р. Г. Бутенко (1969), этот фактор водорастворим, термостабилен, не заменяется фитогормонами, включает низкомолекулярные вещества. Химическая природа кондиционирующего фактора доказывается с помощью довольно простого эксперимента. Если разделить одиночные клетки и ткань-«няньку» стеклянной пластиной, то деления клеток не наступает. Если вместо пластин поместить целлофан, то хотя и с задержкой начинается деление одиночных клеток (рис. 7.3).
ОБЩАЯ ХАРАКТЕРИСТИКА КАЛЛУСНЫХ КЛЕТОК
Каллусная клетка имеет свой цикл развития, аналогичный циклу всех других клеток: деление, растяжение, дифференцировку, старение и отмирание. Дифференцировку каллусных клеток принято называть вторичной. Однако ее не следует путать с вторичной дифференцировкой, на которой основан морфогенез. Рост каллусных тканей подчиняется общим закономерностям. Кривая роста каллусных тканей также имеет характер 5-образной кривой (ростовая кривая Сакса) и включает пять фаз, длительность которых неодинакова у разных видов растений (рис. 7.4).
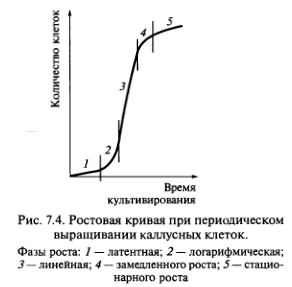
Первая фаза — латентная, или лаг-фаза, заключается в подготовке клеток к делениям. Вторая — фаза экспоненциального роста (логарифмическая). В это время митотическая активность наибольшая, рост идет с ускорением, масса каллуса увеличивается. Третья фаза — линейная, характеризуется постоянной скоростью роста каллусной массы. Четвертая — фаза замедленного роста, во время которой интенсивность деления клеток резко снижается. Во время пятой фазы — стационарной — масса каллуса не увеличивается, так как начавшееся отмирание клеток еще компенсируется за счет их деления. Далее следует отмирание каллуса.
Культивируемые каллусные клетки и ткани сохраняют многие физиологические особенности, свойственные клеткам растения, из которого они были получены. Сохраняются, например, такие свойства, как морозостойкость, устойчивость к абиотическим факторам (температура, засоление, фотопериодическая реакция), а главное, хотя и в разной степени, способность к синтезу вторичных метаболитов. Наряду с общими у каллусных клеток появляются свои, характерные только для них особенности. Например, длительно культивируемые in vitro клетки высших растений, как каллусные, так и суспензионные, образуют специфическую популяцию, относящуюся к типу неполовых, — популяцию соматических клеток. Наиболее характерные свойства этой популяции — физиологическая асинхронность и генетическая гетерогенность.
Физиологическая асинхронностъ — наиболее важное свойство неполовой популяции. Оно заключается в том, что в каждый данный момент времени клетки находятся в разных фазах роста: одни делятся, другие растут, а третьи уже стареют. Поэтому общее физиологическое состояние такой популяции принято оценивать по состоянию большинства клеток.
Причины возникающей асинхронности весьма разнообразны:
- Особенности вида, сорта, генотипа индивидуального растения, а также особенности экспланта.
- Стрессы культивирования, например неоптимальная для данного вида клеток среда.
- Изменение баланса эндогенных гормонов и концентрации в среде экзогенных гормонов в течение выращивания.
- Генетическая гетерогенность клеток и клонов.
- Аномалия митотического цикла клеток in vitro.
- Физические факторы (температура, свет, аэрация).
Асинхронность — устойчивое свойство популяции каллусных клеток. Если с помощью специфических воздействий синхронизировать пролиферацию клеток популяции, то уже через 3—4 деления она вновь становится асинхронной.
Генетическая гетерогенность — свойство клеток соматической популяции (нестабильность генома и их генетическая гетерогенность). Генетически стабильными считаются только клетки меристематических тканей. В клетках остальных тканей при культивировании могут возникать полиплоидия, анеуплоидия, хромосомные аберрации, генные мутации. Однако генетическую гетерогенность нельзя рассматривать как недостаток, так как она является необходимым условием существования популяции клеток и служит основой для их адаптации.
В качестве причин появления генетической гетерогенности можно назвать следующие:
- Генетическая гетерогенность исходного материала. В растениях клетки характеризуются различной плоидностью, диплоидны только активно делящиеся меристематические клетки.
- Нарушение коррелятивных связей при выделении первичного экспланта из растения.
- Действие компонентов среды. Экзогенные гормоны и стимуляторы могут оказывать мутагенное действие. Ауксины, особенно
2,4-D, входящие в состав питательных сред, — мутагены; цитокинины способствуют полиплоидизации клеток. - Длительное субкультивирование, при котором накапливаются генетически измененные каллусные клетки.
После 5 — 6 пересадок новый кариотип клеточной популяции, как правило, стабилизируется, если условия культивирования остаются постоянными. В противном случае изменение физических или трофических факторов приведет к новым генетическим изменениям.
Генетическая нестабильность каллусных клеток имеет большое значение для селекционной работы, так как позволяет отбирать штаммы клеток с измененным генотипом. Эти клетки могут обладать уникальными свойствами: повышенной устойчивостью к неблагоприятным факторам, повышенной продуктивностью и т.д. Однако генетическая гетерогенность популяций каллусных клеток в культуре не влияет на сохранение в их геноме основных качеств вида и растения-донора.
Гормоннезависимостъ. Хотя гормоны и вызывают мутации, каллусные ткани от большинства растений образуются только в присутствии в питательной среде и ауксинов, и цитокининов. Исключение составляют, например, незрелые зародыши пшеницы и семядоли подсолнечника. Первые образуют каллусную ткань на питательной среде с 2,4-D, но без цитокининов. Вторые, напротив, — на среде, содержащей цитокинины, но без ауксинов.
Вероятно, такая специфика связана с эндогенным содержанием фитогормонов и с компетентностью клеток. Однако при длительном культивировании практически у всех тканей может возникать специфическое свойство гормоннезависимости, т.е. автономности по отношению к ауксинам и цитокининам. Эти ткани могут расти на среде без гормонов, что делает их похожими на опухолевые клетки и резко отличает от нормальных каллусных тканей. Внешне же такие гормоннезависимые ткани ничем не отличаются от каллусных. Клетки, которые в процессе культивирования приобрели свойство автономности от присутствия в среде гормонов, называются «привыкшими». Ткани, образованные такими «привыкшими» клетками, называют «химическими опухолями» в отличие от растительных или генетических опухолей. Генетические опухоли возникают на межвидовых гибридах растений. Растительные опухоли имеют бактериальное или вирусное происхождение. Чаще всего растительные опухоли возникают при попадании в растения агробактерий. Так, Agrobacterium tumefaciens вызывает образование корончатых галлов, A. rhizodenes — бородатого корня, A. rubi — стеблевого галла. Превращение растительных клеток в опухолевые связано с проникновением в них ДНК бактериальной клетки, так называемой Ti-плазмиды, которая значительно изменяет свойства клетки, в том числе экспрессирует гены, контролирующие синтез ауксинов и цитокининов. Гормоннезависимость «привыкших» клеток связана с изменением активности собственных генов, ответственных за синтез белков-ферментов, участвующих в синтезе гормонов. Таким образом, «привыкшим» тканям и растительным опухолям в равной степени свойственна гормоннезависимость, но у растительных опухолей она носит генетический характер. У «привыкших» клеток это свойство достигается главным образом за счет эпигеномных изменений. Существует еще одна особенность, позволяющая отличить «привыкшие» и опухолевые клетки от обычных каллусных. Обычно ни опухолевые, ни «привыкшие» ткани не способны к нормальной регенерации. Они могут образовывать уродливые органоподобные структуры, так называемые тератомы. В отдельных случаях у длительно культивируемых тканей удается отодвинуть порог «привыкания» благодаря изменению состава питательных сред и добиться регенерации нормального растения.
МОРФОГЕНЕЗ В КАЛЛУСНЫХ ТКАНЯХ КАК ПРОЯВЛЕНИЕ ТОТИПОТЕНТНОСТИ РАСТИТЕЛЬНОЙ КЛЕТКИ
Дифференцировка каллусных тканей. Одна из наиболее интересных, но сложных проблем в биологии — развитие многоклеточных организмов. Изучение данного вопроса возможно несколькими путями. Так, большое распространение получило моделирование процессов онтогенеза на более простых системах. При этом используют изолированные ткани, клетки, протопласты, культивируемые в стерильных условиях. Преимущество этого процесса состоит в том, что нет необходимости постоянно учитывать результаты взаимодействия органов в целостной системе растительного организма. Кроме того, экспериментатор сам имеет возможность выбирать, изменять и повторять условия опыта в соответствии с поставленной задачей. После завершения дедифференцировки дальнейшее развитие каллусной клетки может идти в нескольких направлениях. Во-первых, это вторичная дифференцировка разной степени сложности. Во-вторых, в клетке может сформироваться состояние стойкой дедифференцировки («привыкание»), а следовательно, способность расти на безгормональной среде. В-третьих, каллусная клетка проходит свой цикл развития, завершающийся ее старением и отмиранием.
Наибольший интерес вызывает первый путь, фактически представляющий морфогенные процессы. В культуре каллусных тканей морфогенезом называют возникновение организованных структур из неорганизованной массы клеток.
Вторичная дифференцировка каллусной клетки может завершиться образованием в каллусной ткани отдельных дифференцированных клеток. Они имеют определенное строение и выполняют специфические функции. Примером служит образование эпибластов — клеток, в которых запасаются вторичные метаболиты. Это наиболее простой тип дифференцировки каллусной клетки. Более сложная гистологическая дифференцировка завершается образованием в каллусе различных тканей: млечников, волокон, трихом, элементов ксилемы (трахеи и трахеиды) и флоэмы (ситовидные трубки и клетки-спутницы). К самым сложным видам вторичной дифференцировки относятся органогенез — образование органов и соматический эмбриогенез — образование из соматических клеток эмбриоидов, биполярных зародышеподобных структур. Все эти типы дифференцировки возможны только благодаря тотипотентности: любая растительная клетка содержит полный набор генов, характерный для того организма, из которого она была выделена. Потенциальные возможности всех клеток этого растения одинаковы; каждая из них в определенных условиях может дать начало целому организму. Однако выяснено, что реально детерминируется только одна из 400—1000 клеток, что, вероятно, связано с физиологическим состоянием клетки, с ее компетентностью. Так, у эксплантов стеблевого происхождения компетентны к действию экзогенных фитогормонов и, следовательно, способны к морфогенезу только клетки эпидермальных и субэпидермальных тканей (Тран Тан Ван, 1981). Однако компетентность клеток может приобретаться ими в процессе культивирования каллусной ткани, в условиях, индуцирующих морфогенез. Время, в течение которого в каллусных клетках возникает это свойство, изменяется в широких пределах. Кроме того, существенную роль в дифференциации играют генотип растения-донора, условия и физические факторы культивирования.
Все каллусные клетки, готовые ко вторичной дифференцировке, т. е. детерминированные, характеризуются общими чертами. Эти клетки — «клетки-инициали»— образуют утолщенную клеточную стенку, обособляясь от остальных каллусных клеток. Для них характерно более крупное ядро, большее количество запасных веществ, меньшие размеры вакуолей. В «клетках-инициалях» начинается синтез определенных белков, интенсифицируется пентозофосфатный путь расщепления гексоз. Очень важно, что между этими клетками, формирующими меристематические очаги, восстанавливаются плазмодесмы, которые практически отсутствуют в массе каллусных клеток.
Интересное предположение было высказано Л. Саксом и С. Тойвоненом (1963). Оно сводится к тому, что существует минимальная масса каллусных клеток, которая определяет способность уже детерминированных клеток к дальнейшему морфогенезу. Это подтвердилось в опытах с культурой семядолей ели: детерминация адвентивных побегов происходила в клеточных комплексах из 5 — 6 клеток (Б. С. Флинн и др., 1988). В исследованиях С.Номура и А. Комамине (1989) было показано, что развитие соматических зародышей детерминируется в 6— 10-клеточном агрегате.
Гистогенез. Главную роль в преобразовании каллусных клеток в сосудистые элементы играют фитогормоны, в основном ауксины. Опыты по влиянию апикальной меристемы побега (место синтеза ауксинов) на гистогенез в каллусной ткани показали, что ниже места прививки апекса в каллусной ткани начинали образовываться сосудистые элементы. Тот же эффект наблюдался при нанесении на каллус ауксина с сахарозой. Интересно, что повышение концентрации сахарозы способствовало образованию элементов флоэмы, а понижение — образованию ксилемных элементов. Причем такое действие оказывала совместно с ауксином только сахароза, что позволяет говорить о ее регуляторной роли. Добавление к гормону других Сахаров гистогенеза не вызывало. В некоторых случаях стимуляторами гистогенеза помимо ауксинов могут быть и остальные фитогормоны. Так, было отмечено, что в каллусных тканях сои этот процесс начинается под действием гиббе-релловой кислоты и этилена.
Органогенез. Первые работы Ф.Скуга и С.Миллера по влиянию ауксинов и открытого ими кинетина на органогенез в каллусах растений показали прямую зависимость этого процесса от соотношения фитогормонов. Преобладание концентрации ауксина над цитокинином вызывает дифференцировку клеток, приводящую к образованию корневой системы. В этом случае регенерации целого растения не происходит. При увеличении концентрации цитокинина и уменьшении ауксина начинаются стеблевой органогенез и образование побега. Если его пересадить на свежую питательную среду с преобладанием ауксина, то наблюдается образование корней и регенерация целого растения. В настоящее время доказано, что для прохождения органогенеза очень большое значение имеют принадлежность растения-донора к классу двудольных или однодольных, его генотип, а также тип экспланта. Кроме того, морфогенез можно получить только при условии подбора оптимальной питательной среды, определенных физических факторов, балансе фитогормонов, присутствии сигнальных белков и белков-акцепторов в клетках.
Среди компонентов, входящих в состав питательных сред, важную роль играют ионы NH4+ и NO3~. Присутствие аммонийного азота важно для начала морфогенеза, а добавление нитратного азота способствует росту и развитию образовавшихся структур. Фитогормоны, используемые для стимуляции органогенеза, не ограничиваются теперь только ауксинами и цитокининами. С этой целью в питательную среду вводят другие классы фитогормонов: абсцизины, гиббереллины, этилен.
Влияние типа экспланта на морфогенез было четко показано в работах Н. П. Аксеновой, Т. В. Бавриной, Т. Н. Константиновой. Они установили, что только экспланты, выделенные из верхних междоузлий, могут образовывать каллус, способный к флоральному морфогенезу. Каллусы, полученные на эксплантах из нижних междоузлий, давали начало только вегетативным органам.
Вопрос о механизме запуска вторичной дифференцировки у каллусных клеток остается открытым. В настоящее время самое раннее событие, связанное с морфогенезом, — это появление тканеспецифичных белков. Установлено, что все морфогенетические изменения активируются и (или) контролируются специальными генами.
Соматический эмбриогенез. При соматическом эмбриогенезе клетка-инициаль дает начало зиготе. Регенерант, образующийся из соматического зародыша, полностью сформирован, что устраняет лишние затраты по укоренению полученных при органогенезе побегов. Кроме того, соматические эмбриоиды точнее воспроизводят генотип исходного растения по сравнению с растениями-регенерантами, полученными в результате органогенеза. Соматические зародыши представляют и чисто практический интерес, так как могут быть использованы для получения искусственных семян.
Соматический эмбриогенез очень важен для фундаментальных наук. Он позволяет изучать механизмы эмбриогенеза, так как почти все его фазы, за исключением первой, в растении и в культуре тканей совпадают. Наиболее ранняя из изученных фаз детерминации клетки по эмбриональному пути развития состоит в приобретении ею свойств полярности. Так, при определении плотности биоэлектрического потенциала для четырех морфогенных клеток оказалось, что максимальная плотность электрического тока была на полярных полюсах этой группы клеток. Переход клеток в следующую фазу эмбриогенеза сопровождался значительным повышением плотности тока. Предполагается, что морфогенные клетки могут поддерживать полярность за счет активного базипетального транспорта эндогенного ауксина, градиента биоэлектрических потенциалов, градиента ионов кальция.
В связи с этим особый интерес представляют работы Ю. Б.Долгих (1994), в которых было установлено, что слабый постоянный электрический ток (2 мкА) может быть индуктором эмбриогенеза. Соматический эмбриогенез фактически не зависит от экзогенных фитогормонов, только развитие сформировавшихся соматических зародышей начинается в отсутствие ауксинов в среде. Однако содержание эндогенных фитогормонов имеет решающее значение для индукции эмбриогенеза.
На регуляцию морфогенеза существенно влияет качество света. Показано (Л. Коппель, 1992), что морфогенный каллус образуется чаще на синем свету, чем на белом или красном. Изменения на уровне индивидуальных белков во время реализации морфогенетической программы в культуре тканей позволили говорить о существовании белков развития. Однако отсутствие специфических тестов на эти белки не позволяет их выявить. Вместе с тем при использовании гибридов, продуцирующих моноклональные антитела на мембранные белки соматических зародышей, удалось выявить полипептид с молекулярной массой 45 кДа, который встречается в ядре нескольких видов растений и возможно участвует в регуляции клеточного деления (Г.Смит и др., 1988). В настоящее время большое внимание уделяется генетическому аспекту морфогенеза, изучению соматического эмбриогенеза как генетически наследуемого признака. Роль основного двигателя процесса развития отводится дифференциальной активности генов. Предполагается, что гены, контролирующие соматический эмбриогенез, начинают экспрессироваться в критические периоды развития эмбриоидов (Н.А.Моисеева, 1991).
ИЗОЛИРОВАННЫЕ ПРОТОПЛАСТЫ, ИХ ПОЛУЧЕНИЕ И КУЛЬТИВИРОВАНИЕ
Впервые термин «изолированные протопласты» был предложен Д. Ханстейном в 1880 г. Протопласт в целой клетке можно наблюдать во время плазмолиза. Изолированный протопласт — это содержимое растительной клетки, окруженное плазмалеммой. Целлюлозная стенка у данного образования отсутствует. Изолированные протопласты — одни из наиболее ценных объектов в биотехнологии. Они позволяют исследовать различные свойства мембран, а также транспорт веществ через плазмалемму. Главное их преимущество состоит в том, что в изолированные протопласты достаточно легко вводить генетическую информацию из органелл и клеток других растений, прокариотических организмов и из клеток животных. Е. Коккинг установил, что изолированный протопласт благодаря механизму пиноцитоза способен поглощать из окружающей среды не только низкомолекулярные вещества, но и крупные молекулы, частицы (вирусы) и даже изолированные органеллы.
Большое значение в создании новых форм растений для изучения взаимодействия ядерного генома и геномов органелл имеет способность изолированных протопластов сливаться, образуя гибридные клетки. Таким способом можно добиться получения гибридов от растений с разной степенью таксономической удаленности, но обладающих ценными хозяйственными качествами.
Впервые протопласты были выделены Дж. Клернером в 1892 г. при изучении плазмолиза в клетках листа телореза {Stratiotes abides) во время механического повреждения ткани. Поэтому этот метод назван механическим. Он позволяет выделить лишь небольшое количество протопластов (выделение возможно не из всех видов тканей); сам метод длительный и трудоемкий. Современный метод выделения протопластов заключается в удалении клеточной стенки с помощью поэтапного использования ферментов для ее разрушения: целлюлазы, гемицеллюлазы, пектиназы. Этот метод получил название ферментативного.
Первое успешное выделение протопластов из клеток высших растений данным методом сделано Е. Коккингом в 1960 г. По сравнению с механическим ферментативный метод имеет ряд преимуществ. Он позволяет сравнительно легко и быстро выделять большое количество протопластов, причем они не испытывают сильного осмотического шока. После действия ферментов смесь протопластов пропускают через фильтр и центрифугируют для удаления неразрушенных клеток и их осколков.
Выделить протопласты можно из клеток растительных тканей, культуры каллусов и суспензионной культуры. Оптимальные условия для изоляции протопластов для разных объектов индивидуальны, что требует кропотливой предварительной работы по подбору концентраций ферментов, их соотношения, времени обработки. Очень важным фактором, позволяющим выделять целые жизнеспособные протопласты, является подбор осмотического стабилизатора. В качестве стабилизаторов обычно используют различные сахара, иногда ионные осмотики (растворы солей СаС12, Na2HPO4, КС1). Концентрация осмотиков должна быть немного гипертонична, чтобы протопласты находились в состоянии слабого плазмолиза. В этом случае тормозятся метаболизм и регенерация клеточной стенки.
Изолированные протопласты можно культивировать. Обычно для этого используют те же среды, на которых растут изолированные клетки и ткани. Сразу же после удаления ферментов у протопластов в культуре начинается образование клеточной стенки. Протопласт, регенерировавший стенку, ведет себя как изолированная клетка, способен делиться и формировать клон клеток. Регенерация целых растений из изолированных протопластов сопряжена с рядом трудностей. Получить регенерацию через эмбриогенез удалось пока только у растений моркови. Стимуляцией последовательного образования корней и побегов (органогенез) добились регенерации растений табака, петунии и некоторых других растений. Следует отметить, что протопласты, изолированные из генетически стабильной клеточной культуры, чаще регенерируют растения и с большим успехом используются при исследованиях генетической модификации протопластов.
