4.4. Ингибирование ферментов
Биология — Тейлор Д., Грин Н., Стаут У. 1 том — 2013
Известны различные низкомолекулярные соединения, которые могут снижать скорость ферментативных реакций. Такие соединения называются ингибиторами ферментов. Важно понимать, что ингибирование — это один из нормальных способов регулирования активности ферментов. Многие лекарственные препараты и яды также действуют как ингибиторы ферментов. Ингибирование бывает конкурентным и неконкурентным. Неконкурентное ингибирование может быть обратимым и необратимым.
4.4.1. Конкурентное ингибирование
В этом случае вещество, близкое по своей структуре к обычному субстрату фермента, соединяется с активным центром фермента, но не может прореагировать с ним. Находясь здесь, оно преграждает доступ к активному центру любой молекуле настоящего субстрата. Поскольку в этом случае ингибитор и субстрат конкурируют за место на активном центре фермента, эту форму ингибирования называют конкурентным ингибированием. Для конкурентного ингибирования характерно, что, если концентрация субстрата увеличивается, то скорость реакции возрастает, т. е. это ингибирование обратимо. Рис. 4.12 иллюстрирует один из примеров конкурентного ингибирования.

Рис. 4.12. Конкурентное ингибирование. А. Простая схема, поясняющая механизм ингибирования. Б. Фермент сукцинатдегидрогеназа катализирует превращение янтарной кислоты в фумаровую. В. Конкурентное ингибирование фермента малоновой кислотой.
Явление конкурентного ингибирования помогает понять механизм действия некоторых лекарственных препаратов, в частности сульфаниламидов. Цель химиотерапии — уничтожить при помощи тех или иных химических препаратов возбудителя болезни, не повреждая при этом ткани организма-хозяина. Первыми такими препаратами были сульфаниламиды, антибактериальное действие которых было обнаружено в 30-е годы XX в. Во время Второй мировой войны их широко применяли для борьбы с раневыми инфекциями. Сульфаниламиды по своей химической природе близки к парааминобензойной кислоте (ПАБК) — необходимому фактору роста многих патогенных бактерий. ПАБК требуется бактериям для синтеза фолиевой кислоты, которая служит у них одним из кофакторов ферментов. Сульфаниламиды ингибируют один из ферментов, участвующих в синтезе фолиевой кислоты из ПАБК.
Животные клетки нечувствительны к сульфаниламидам, хотя им для некоторых реакций и требуется фолиевая кислота. Объясняется это тем, что они используют уже образованную фолиевую кислоту; метаболический путь, который бы обеспечивал ее синтез, у них отсутствует.
4.4.2. Неконкурентное обратимое ингибирование
Ингибиторы этого типа не родственны по своей структуре субстрату данного фермента; в образовании комплекса с ингибитором в этом случае участвует не активный центр фермента, а какаянибудь другая часть его молекулы. Это не препятствует соединению субстрата с ферментом, но делает невозможным катализ. С повышением концентрации ингибитора скорость реакции все более снижается. К моменту насыщения ингибитором она оказывается практически равной нулю. В отличие от конкурентного ингибирования в этом случае повышение концентрации субстрата на скорость реакции не влияет.
4.4.3. Неконкурентное необратимое ингибирование
Некоторые вещества вызывают необратимое ингибирование ферментов. Рассмотрим два примера такого рода. Очень малые концентрации ионов тяжелых металлов, например ионов ртути (Hg2+), серебра (Ag+) и мышьяка (As+), а также определенные иодсодержащие соединения полностью ингибируют некоторые ферменты. Эти вещества необратимо соединяются с сульфгидрильными группами (–SH) в молекуле фермента (рис. 4.13), причем сульфгидрильные группы могут находиться как в активном центре фермента, так и вне его.
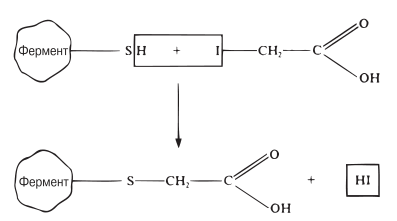
Рис. 4.13. Необратимое ингибирование фермента йодуксусной кислотой. Йод вступает в реакцию с сульфгидрильными группами фермента.
В любом случае структура фермента нарушается и он теряет способность осуществлять катализ. Может произойти и осаждение ферментного белка.
Другой пример необратимого ингибирования — действие диизопропилфторфосфата (ДФФ), соединения из группы нервно-паралитических отравляющих веществ. ДФФ связывается с остатком аминокислоты серина, находящимся в активном центре фермента ацетилхолинэстеразы. Этот фермент инактивирует ацетилхолин, играющий роль нейромедиатора.
Одна из функций ацетилхолина заключается в обеспечении передачи нервного импульса от одного нейрона к другому через синаптическую щель (гл. 17). Почти сразу после передачи очередного импульса ацетилхолинэстераза инактивирует ацетилхолин, расщепляя его молекулы.
Если ацетилхолинэстераза ингибирована, то ацетилхолин накапливается, нервные импульсы следуют один за другим, и мышца длительное время не расслабляется. В конце концов наступает паралич, а может наступить и смерть, поскольку затронутыми оказываются также мышцы грудной клетки, в результате чего происходит остановка дыхания. Некоторые из применяемых в настоящее время инсектицидов (например, паратион) оказывают такое же действие на насекомых. Нервную и мышечную системы человека они тоже способны повреждать.
4.4.4. Аллостерические ферменты
Один из самых обычных способов регуляции метаболических путей — это регуляция с помощью аллостерических ферментов. Аллостерическими называют ферменты, действие которых «по определению» связано с изменением формы (allos — иной, другой; stereоs — форма).
Активность таких ферментов регулируют вещества, действующие подобно неконкурентным ингибиторам. Эти вещества присоединяются к ферментам в особых участках, удаленных от активного центра, и меняют активность фермента, вызывая обратимое изменение в структуре активного центра. В результате меняется способность субстрата связываться с ферментом (чем данное явление и отличается от неконкурентного ингибирования; разд. 4.4.2). Действующие таким образом вещества называются аллостерическими ингибиторами. Рис. 4.14 поясняет механизм аллостерического ингибирования.
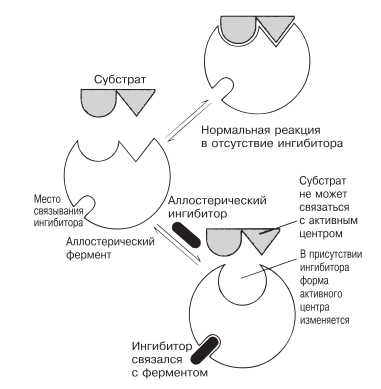
Рис. 4.14. Аллостерическое ингибирование.
Примером данного явления служит реакция, протекающая во время гликолиза, который составляет одну из стадий процесса клеточного дыхания. Клеточное дыхание служит источником АТФ. Если концентрация АТФ высока, то АТФ, действуя как аллостерический ингибитор, подавляет активность одного из ферментов гликолиза.
Если же клеточный метаболизм усиливается, а следовательно, АТФ расходуется и его общая концентрация падает, то после того как ингибитор будет удален, данный метаболический путь снова вступает в действие. Это может также служить примером ингибирования конечным продуктом.
Ингибирование конечным продуктом (ингибирование по принципу отрицательной обратной связи — ретроингибирование)
Когда конечный продукт какого-либо метаболического пути начинает накапливаться, он может действовать как аллостерический ингибитор на фермент, контролирующий первый этап этого пути. Таким образом, продукт, накапливаясь, приостанавливает свое дальнейшее образование.
Процесс этот саморегулирующийся: как только продукт будет израсходован, его образование возобновится. Данное явление — ингибирование конечным продуктом — представляет собой пример механизма, действующего по принципу отрицательной обратной связи (рис. 4.15).
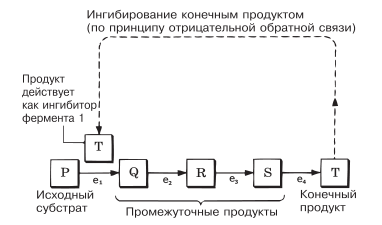
Рис. 4.15. Ингибирование конечным продуктом. Специфические ферменты, катализирующие отдельные этапы данного метаболического пути, обозначены буквами e1 – e4.
