Хроническая болезнь почек
Лекции по нефрологии — Иванов Дмитрий Дмитриевич — 2010
- Понятие хронической болезни почек
- Практические аспекты лечения хронической болезни почек
- Фосфорно-кальциевый обмен при хронической болезни почек
Понятие хронической болезни почек
С 2002 года по инициативе NKF-KDOQI™ в современной нефрологии используется понятие хронической болезни почек (ХБП, CKD — chronic renal disease) и классификация стадий хронической болезни почек. В 2003 году термин предложен также для использования в детской нефрологии. В 2005 году на 2-м съезде нефрологов Украины утверждены термины «хроническая болезнь почек» для взрослых пациентов и «хроническое заболевание почек» (ХЗП) для детей. Эта терминология носит собирательный характер и сходна с такими понятиями, как, например, ишемическая болезнь сердца (ИБС) или хронические неспецифические заболевания легких (ХНЗЛ).
Целесообразность использования термина «ХБП» в качестве диагноза несколько отличается для общей практики и специалистов. Так, в разъяснении определения и классификации хронической болезни почек A.S. Levey с соавт. было отмечено, что врачам общей практики нецелесообразно включать название заболевания почек в диагноз ХБП. Врач общей практики, гипертензиолог, диабетолог чаще диагностируют ХБП без нозологической верификации, заменяя известное ранее понятие «нефропатия». Нефрологом, прежде всего, подразумевается, что хроническая болезнь почек, как правило, прогрессирует с развитием хронической почечной недостаточности (ХПН). Именно понимание прогрессирования почечного процесса, его необратимости легло в основу терминологического выделения «хроническая болезнь почек», а не «хроническое заболевание почек». Вместе с тем в детском возрасте возможно обратное развитие хронического повреждения почек и восстановление функции органа, в связи с чем в приказе МЗ Украины № 365 от 20.07.05 используется термин «ХЗП».
Наличие хронической болезни почек должно устанавливаться независимо от первичного диагноза, исходя из признаков повреждения почек и/или скорости клубочковой фильтрации (СКФ). При этом ХБП может сама рассматриваться как диагноз, например: ХБП, 3-я стадия, гипертоническая болезнь, 2-я стадия, III степень, дефицитная анемия, 1-я степень. Диагноз «хроническая болезнь почек» еще не квалифицирован согласно МКБ-Х, но уже входит в последнюю редакцию Американского классификатора болезней.
Пациент имеет хроническую болезнь почек, если присутствует любой из следующих критериев:
1. Повреждение почек > 3 месяцев, которое обнаружено по структурным или функциональным нарушениям почек со снижением скорости клубочковой фильтрации или без него, и проявление 1 или более из следующих признаков:
— нарушение в анализах крови или мочи;
— нарушение, выявленное при визуализационных исследованиях;
— нарушения, обнаруженные при биопсии почки.
2. Скорость клубочковой фильтрации < 60 мл/мин/1,73 м2 на протяжении > 3 месяцев с другими признаками повреждения почек, приведенными выше, или без них.
Считается, что в популяции 10—17 % людей страдают ХБП. При этом диагностирована болезнь лишь у 1 % населения. Ежегодный прирост диализной ХПН (ХБП 5-й ст.) составляет около 100 пациентов на 1 млн населения, находясь в пределах от 60 в странах с холодным климатом до 150 больных в южных государствах. Данные о распространенности хронической болезни почек представлены в исследовании NeoERICA (рис. 1.1).
К сожалению, часто наблюдается гиподиагностика ХБП. Например, ХБП в США страдают около 20 миллионов жителей. Анализ, приведенный в исследовании NHANES III (National Health and Nutrition Examination Survey), свидетельствует о наличии у 11 % из 19,2 млн обследованных американцев хронической болезни почек, а именно: 3,3 % имели первую стадию ХБП (персистирующая микроальбуминурия со СКФ > 90 мл/мин); 3 % — вторую стадию ХБП (СКФ 60-89 мл/мин); 4,3 % — третью стадию (СКФ 30-59 мл/мин); 0,2 % — четвертую (СКФ 15-29 мл/мин) и 0,1 % — пятую (СКФ < 15 мл/мин).

Рисунок 1.1. Распространенность хронической болезни почек согласно данным исследования NeoERICA (n = 41296) Примечание: * — распространенность среди населения Великобритании (%).
Хроническая болезнь почек может быть диагностирована без известной причины, так как для ее установления могут потребоваться специфические знания и/или проведение диагностических процедур, недоступных широкому кругу врачей.
Результаты анализа мочевого осадка, визуализационные исследования почки и некоторые клинические симптомы позволяют обнаружить разные варианты хронической болезни почек, в том числе гломерулярные, сосудистые, тубулоинтерстициальные и кистозные. При этом считается, что все реципиенты с почечным трансплантатом, независимо от скорости клубочковой фильтрации, наличия или отсутствия маркеров поражения почек, имеют хроническую болезнь почек.
Для врачей общей практики рекомендуется помнить, что оценка анализа мочи по индикаторной тест-полоске и микроскопическое исследование мочевого осадка, выявление протеинурии необходимы для установления ХБП и идентификации типа заболевания почки. Визуализационные исследования рекомендуются для большинства пациентов с известной ХБП и у пациентов с повышенным риском развития ХБП. Инвазивные процедуры, такие как биопсия почки, целесообразны, например, в диагностике гломерулонефритов или гломерулопатий. Некоторые клинические симптомы ХБП могут вызывать характерные изменения в крови, например, при почечном канальцевом ацидозе или нефрогенном несахарном диабете.
Напомним, что в норме с мочой выделяется довольно малое количество белка, не превышающее 10 мг/мл, а при некоторых состояниях (физическая нагрузка, гипертермия) — до 150 мг/л у взрослых и 50 мг/л у детей. Постоянно повышенная экскреция белка, как правило, является маркером повреждения почек. Экскреция специфических типов белков, таких как альбумины или низкомолекулярные глобулины, зависит от типа поражения почек. Повышенная экскреция альбумина является чувствительным маркером ХБП, вызванной сахарным диабетом, гломерулярными болезнями или гипертензией. Повышенная экскреция низкомолекулярных глобулинов является чувствительным маркером некоторых типов тубулоинтерстициальных болезней. В этих случаях термин «протеинурия» означает повышенную экскрецию с мочой альбумина, других специфических белков или общего белка; «альбуминурия» означает специфически повышенную экскрецию альбумина. «Микроальбуминурия» означает экскрецию альбумина выше нормальной, но ниже уровня, к которому чувствительны индикаторные тесты для определения общего белка.
В большинстве случаев для выявления и контроля протеинурии следует использовать случайные разовые порции мочи. Как правило, для этих исследований нет необходимости в сборе мочи длительное время (ночные или суточные порции). Желаемой является первая утренняя порция, но возможно использование случайных порций, если утренняя порция не собрана. В большинстве случаев скрининг с помощью индикаторных тест-полосок является приемлемым для выявления протеинурии:
- Допустимо применение стандартной индикаторной тестполоски для выявления повышенной экскреции белка в моче (может использоваться амбулаторно врачом).
- Альбумин-специфические индикаторные тест-полоски предназначены для выявления альбуминурии (метод сухой химии или определение специфических антител к альбумину).
У пациентов с позитивными тестами с помощью индикаторных тест-полосок (1+ или больше) протеинурия должна быть подтверждена с помощью количественных методов (отношение белок/креатинин или альбумин/креатинин) на протяжении 3 месяцев.
У пациентов с наличием двух из трех или больше положительных количественных тестов в интервале 1—2 недели следует диагностировать персистирующую протеинурию и назначить им дополнительное обследование.
В большинстве случаев именно разовые порции мочи, а не суточная моча должны использоваться для выявления и контроля протеинурии. Наиболее приемлемой является первая утренняя порция, поскольку концентрация белка в моче может очень значительно колебаться на протяжении дня. По данным больших исследований, распространенность протеинурии среди здоровых, когда берется во внимание лишь случайная разовая порция мочи, колеблется от 5 до 15 %. Выявление персистирующей протеинурии в повторных образцах мочи в подобных исследованиях встречается намного реже.
Большинство пациентов, у которых обнаружена протеинурия, не выявляемая при повторных обследованиях, следует рассматривать как имеющих транзиторную протеинурию, т.е. доброкачественное состояние, обусловленное, например, лихорадкой, стрессом или физическими нагрузками.
Таким образом, при подозрении на наличие ХБП руководство NKF-KDOQI™ рекомендует:
- — исследовать уровень креатинина крови для последующего расчета скорости клубочковой фильтрации (рСКФ);
- — тестировать анализ мочи на наличие альбуминурии/протеинурии.
Авторы этих рекомендаций исходят из того, что наиболее часто ХБП сопровождается снижением СКФ и наличием микроальбуминурии. Результаты исследования NHANESIII свидетельствуют, что у 20 % пациентов с диабетом и 43 % — с гипертензией при отсутствии протеинурии наблюдается СКФ менее 30 мл/мин. У 20 % пациентов с диабетом и 14,2 % — с гипертензией без диабета отмечалась СКФ менее 60 мл/мин, а количество таких пациентов росло с увеличением возраста. Результаты исследования свидетельствуют, что распространенность ХБП значительно выше, чем выявлено. При этом показанием для направления пациента к нефрологу является уровень креатинина 133—177 ммоль/л (или СКФ менее 60 мл/мин).
Неблагоприятные последствия ХБП часто могут быть предупреждены или отсрочены путем ранней диагностики и лечения. Первые стадии ХБП выявляются с помощью рутинных лабораторных исследований. Повреждение почки может быть установлено по показателям крови, мочи или по данным визуализационных исследований, а не с помощью биопсии почки. При этом персистирующая протеинурия и гипертензия служат важнейшими признаками повреждения почки. Обоснованием включения лиц с нормальной СКФ в группу ХБП является частая манифестация значительных повреждений почек еще до снижения этого ключевого показателя почечных функций, а также то, что эти пациенты имеют повышенный риск неблагоприятного исхода ХБП. Обоснованием включения лиц со СКФ < 60 мл/мин/1,73 м2 без любых других признаков повреждения почек является то, что снижение почечных функций ниже этого уровня отражает потерю почкой как минимум 50 % своих нормальных функций. Основания для определения СКФ меньше 60 мл/мин как необратимого снижения СКФ заключаются в следующем:
- — наличие скорости клубочковой фильтрации выше отмеченных цифр оставляет время и возможность для лечения почечного заболевания и предупреждения хронической болезни почек;
- — СКФ ниже 60 мл/мин очень редко наблюдается в норме у лиц до 40 лет;
- — уровень СКФ ниже 60 мл/мин связан с ростом числа осложнений хронической болезни почек;
- — СКФ ниже 60 мл/мин ассоциируется с ухудшением прогноза, в частности, с развитием кардиоваскулярных событий и повышением смертности у пациентов с сахарным диабетом или без него;
- — такой граничный уровень и более низкие значения СКФ могут быть определены по формулам расчета СКФ, в которых учтены уровень креатинина сыворотки, масса, пол и возраст пациента.
Перечень основных вариантов ХБП в зависимости от этиологического и патоморфологического факторов приведен в табл. 1.1.
Таблица 1.1. Перечень основных вариантов хронической болезни почек
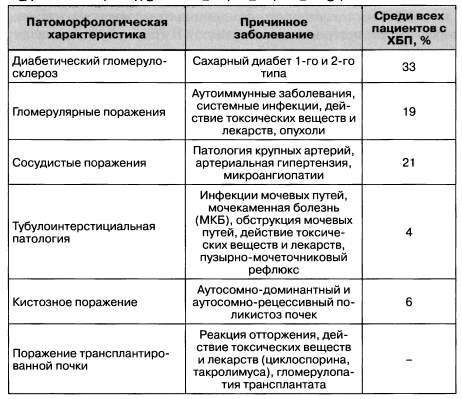
Как следует из данных табл. 1.1, самыми весомыми причинами развития хронической болезни почек (свыше 50 %) во взрослом возрасте являются диабет и гипертензия. Поэтому чаще всего именно они могут быть обнаружены терапевтом, семейным врачом, эндокринологом или кардиологом. При наличии микроальбуминурии и при подозрении на хроническую болезнь почек пациенты должны быть направлены к нефрологу для консультации и коррекции лечения. При уровне СКФ < 30 мл/мин/1,73м2 пациенты обязательно должны консультироваться нефрологом/детским нефрологом. При возможности определения причинного фактора хронической болезни почек диагноз может быть сформулирован таким образом:
- — Гипертоническая болезнь II стадии, 2-я степень. ХБП 3-й стадии: микроальбуминурия. Риск очень высокий. Дефицитная анемия 1-й степени (код 112.9).
- — Сахарный диабет 2-го типа. ХБП 3-й стадии: диабетическая нефропатия 3-й стадии, гипертензия III стадии, 2-я степень.
- — ХБП 4-й стадии: аутосомно-доминантный поликистоз почек, взрослый тип, артериальная гипертензия II стадии, 2-й степени, дефицитная анемия 1-й степени.
Современная терминология предполагает следующие определения наиболее часто встречаемых ХБП:
1. ХБП: наличие изменений в анализах крови или мочи или СКФ < 60 мл/мин длительностью более 3 месяцев (KDOQI, 2003).
2. Диабетическая болезнь почек = диабет + хроническая болезнь почек (KDOQI, 2007; ранее — диабетическая нефропатия).
3. Гипертензивная болезнь почек — ХБП вследствие гипертензии.
4. Ишемическая болезнь почек — ХБП вследствие атеросклероза.
Конечный результат наиболее часто встречаемых ХБП — высокий риск кардиоваскулярной смерти.
Выявление причинного фактора хронической болезни почек позволяет назначить специфическую терапию и значительно отсрочить развитие хронической почечной недостаточности. Сам термин «ХБП» предусматривает, что заболевание прогрессирует с потерей функции почек, к сожалению, в большинстве случаев необратимо.
У детей определен свой перечень заболеваний, которые приводят к развитию ХБП:
- Поликистоз почек или другие генетические болезни почек в семейном анамнезе.
- Малая масса при рождении.
- Острая почечная недостаточность в результате перинатальной гипоксемии или других острых повреждений почек.
- Почечная дисплазия или гипоплазия.
- Урологические аномалии, особенно обструктивные уропатии.
- Пузырно-мочеточниковый рефлюкс, связанный с повторными инфекциями мочевыводящих путей и рубцеванием почек.
- Острый нефрит или нефротический синдром в анамнезе.
- Гемолитико-уремический синдром в анамнезе.
- Болезнь Шенлейна — Геноха в анамнезе.
- Сахарный диабет.
- Системная красная волчанка.
- Гипертензия в анамнезе, в частности, в результате тромбоза почечной артерии или почечной вены в перинатальном периоде. Пример формулировки диагноза: геморрагический васкулит, смешанная форма. ХБП 1-й стадии: гломерулонефрит, изолированный мочевой синдром без нарушения функции почек.
В нефрологии выделяют 4 группы факторов риска, которые влияют на развитие и течение хронической болезни почек. Первая — это факторы, которые могут влиять на развитие хронической болезни почек, а именно: возраст пациента, отягощенный семейный анамнез по наличию ХБП, снижение размеров и объема почек, низкий вес при рождении или недоношенность (окончательное дозревание количества нефронов наблюдается на 38-й неделе внутриутробного развития), низкий материальный доход (социальный статус) и образовательный уровень. Вторая группа — факторы риска, которые инициируют ХБП. Они включают наличие сахарного диабета 1-го и 2-го типа, гипертензию, аутоиммунные заболевания, инфекции мочевых путей, мочекаменную болезнь, обструкцию мочевых путей, токсическое воздействие лекарств. Третья группа — факторы риска, которые приводят к прогрессированию хронической болезни почек, — представлена протеинурией или гипертензией высокой степени, неадекватным контролем гипергликемии, курением. Факторы риска конечной степени ХБП включают низкую диализную дозу, временный сосудистый доступ, анемию, низкий уровень альбумина, позднее начало почечнозаместительной терапии.
В детской нефрологии также выделяют 4 группы риск-факторов развития ХБП:
1. Риск-факторы, имеющие возможное влияние на развитие хронической болезни почек: отягощенный семейный анамнез по наличию хронической болезни почек, уменьшение размеров и объема почек, низкая масса при рождении или недоношенность, низкий материальный достаток или социальный уровень.
2. Риск-факторы, провоцирующие развитие ХБП: СД 1-го и 2-го типа, гипертензия, аутоиммунные заболевания, инфекции органов мочевой системы, МКБ, обструкция мочевых путей, токсическое воздействие лекарственных средств.
3. Риск-факторы прогрессирования хронической болезни почек: высокая степень протеинурии или гипертензии, недостаточный контроль гликемии, курение и потребление наркотиков.
4. Риск-факторы конечной стадии хронической болезни почек: позднее начало почечнозаместительной терапии, низкая диализная доза, временный сосудистый доступ, анемия, низкий уровень альбуминов крови.
Следует отметить, что дозревание нормального количества нефронов наблюдается на 38-й неделе гестации при наличии нормальной массы плода. Поэтому все недоношенные или новорожденные с малым весом тела не имеют нормального количества нефронов. Это является риском развития ХБП, ранней гипертензии и более тяжелого течения приобретенных заболеваний почек.
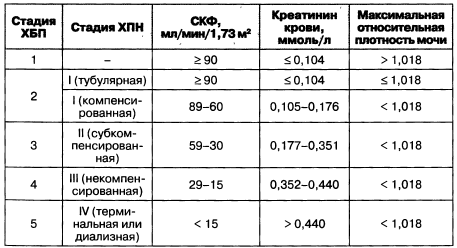
У пациентов с ХБП стадию заболевания необходимо устанавливать исходя из скорости клубочковой фильтрации (табл. 1.2, рис. 1.2).
Таблица 1.2. Стадии хронической болезни почек согласно рСКФ
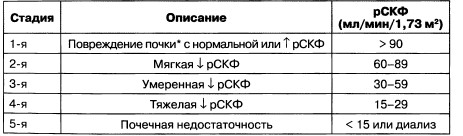
Примечание: * — согласно определению NKF, повреждение почек — это «наличие патологических отклонений или маркеров повреждения, включая отклонения в анализах крови, мочи или выявляемые при визуализационных методах исследования».

Рисунок 1.2. Этапы прогрессирования ХБП
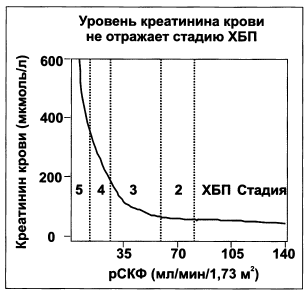
Рисунок 1.3. Уровень креатинина крови в зависимости от СКФ
Следует еще раз обратить внимание, что стадии хронической болезни почек определяются по скорости клубочковой фильтрации, а не по креатинину крови. Это связано с тем, что креатинин крови начинает увеличиваться лишь тогда, когда СКФ уменьшается наполовину от нормальной (рис. 1.3).
Нецелесообразность определения нарушения функции почек по уровню креатинина крови обусловлена тем, что у пациентов с хронической болезнью почек начинается компенсаторная секреция креатинина канальцами, что в норме не происходит. То есть гиперкреатининемия наблюдается при наличии свыше 50 % неработающих нефронов. Кроме того, отличия между клиническими лабораториями в калибровке креатинина достигают 20 %. Поэтому предлагается вообще отказаться от широкой практики рутинного определения СКФ (пробы Реберга — Тареева) ввиду более корректного определения уровня клубочковой фильтрации по креатинину крови с учетом массы тела и возраста пациента или радионуклидного определения данного показателя при проведении реносцинтиграфии, однако этот метод менее доступен.
Сама по себе концентрация креатинина сыворотки крови не должна использоваться для оценки функции почек. В клинических лабораториях возможен расчет СКФ с использованием формулы в дополнение к результатам по уровню креатинина сыворотки. Производители автоматических анализаторов и клинические лаборатории, как правило, калибруют оборудование для определения креатинина сыворотки, используя международный стандарт. Определение клиренса креатинина в моче, собранной за определенный промежуток времени (например, суточной), не улучшает оценку СКФ в сравнении с формулой. Исследование клиренса креатинина по формуле Реберга — Тареева целесообразно:
— для оценки СКФ у лиц с необычным пищевым рационом (вегетарианская диета, пищевые добавки с креатином) или особенностями мышечной массы (профессиональные спортсмены, лица с ампутированными конечностями, гипотрофией, атрофией);
— пациентов с первой стадией диабетической нефропатии (гиперфильтрация при нормальном артериальном давлении (АД) и отсутствии микроальбуминурии);
— оценки диеты и пищевого статуса;
— решения вопроса о необходимости начала диализа.
Для определения расчетной СКФ используют формулы, рекомендованные нефрологическими ассоциациями:
1. Формула Cockroft — Gault:

2. Формула исследования MDRD:

Для перевода сывороточного креатинина с ммоль/л в мг/дл значение в ммоль/л следует умножить на 0,0113.
Расчет по формуле Cockroft — Gault целесообразен при ожидаемой СКФ 60 мл/мин и более, формула MDRD более приемлема для низких значений рСКФ.
Для пациентов детского возраста чаще используется формула Schwartz:
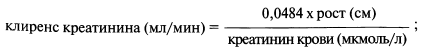
для детей до 3 лет — коэффициент 0,0313, для мальчиков старше 13 лет — коэффициент 0,0616.
Уровень креатинина крови зависит от возраста, пола, расы и поверхности тела пациента. Напомним, что критическим с точки зрения прогрессирования ХБП является снижение СКФ ниже 60 мл/мин. Соотношение СКФ меньше 60 мл/мин с уровнем креатинина приобретает весомое значение с увеличением возраста пациентов (табл. 1.3).
Таблица 1.3. Уровни креатинина крови (мкмоль/л) по двум формулам при СКФ 60 мл/мин
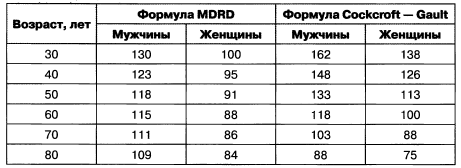
До 30 лет скорость клубочковой фильтрации составляет в среднем 125 мл/мин, затем начинает снижаться на 1 мл/мин ежегодно. При наличии гипертензии, ХБП такая потеря СКФ может достигать 4—6 мл/мин/год, а развитие диабетической болезни почек сопровождается уменьшением СКФ до 12 мл/мин/год.
Существует перечень состояний, при наличии которых скорость клубочковой фильтрации следует измерять с помощью экзогенных маркеров, например инулина (в современных исследованиях — цистацина С), или радионуклидных исследований:
- — ИМС меньше 19 и больше 35 кг/м2;
- — преклонный возраст;
- — беременность;
- — нарушение питания или ожирение;
- — параплегия или тетраплегия;
- — болезни скелетных мышц;
- — вегетарианская диета;
- — быстрые изменения функции почек.
Этот метод должен применяться у возможных доноров почки, при необходимости назначения токсичных лекарств, которые выводятся почками, в клинических исследованиях, в которых влияние на СКФ является конечной точкой.
Для большего удобства и национальной стандартизации уровень креатинина крови может (не совсем корректно!) быть сопоставлен со значениями СКФ. В приказе МЗ Украины № 65/462 от 30.09.2003 приведены значения СКФ и креатинина крови в зависимости от стадии хронической болезни почек и ХПН (табл. 1.4).
Таблица 1.4. Степени ХПН у взрослых
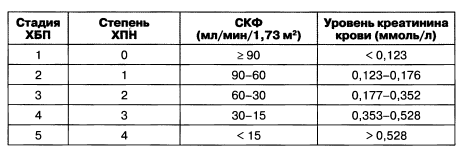
С ростом креатинина крови увеличивается риск развития фатальных кардиоваскулярных событий. Так, в исследовании НОТ приведены данные о зависимости клинических осложнений от уровня креатинина крови, превышающего 130 мкмоль/л (табл. 1.5).
Таблица 1.5. Зависимость частоты осложнений от повышенного уровня креатинина крови
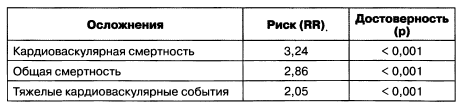
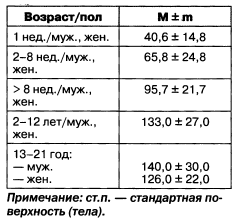
Исходя из данных табл. 5.1, можно сделать выводы о том, что повышенный уровень креатинина крови является более значимым фактором риска наступления смерти, чем другие факторы, например диабет или предшествовавший инфаркт миокарда. У детей нормальные уровни СКФ приведены в табл. 1.6.
Таблица 1.6. Нормальные величины СКФ (мл/мин/ст.п.) у детей и подростков
Классификация ХБП и ХПН у детей приведена в табл. 1.7. Чаще всего хроническая болезнь почек диагностируется при наличии протеинурии и гипертензии, в том числе на фоне сахарного диабета и кардиоваскулярных заболеваний, а также у пациентов с отягощенным семейным анамнезом по ХБП.
Метод, который чаще всего используется в развитых странах для выявления протеинурии в общей практике, — это индикаторная тест-полоска, которая в первую очередь обнаруживает альбумин и является нечувствительной к низкомолекулярным белкам. Цветная реакция между альбумином мочи и тетрабромфеноловым синим дает разные оттенки зеленого цвета в зависимости от концентрации альбумина в образце. В то же время когда клинические лаборатории определяют «протеинурию», оборудование вьывляет как низко-, так и высокомолекулярные глобулины дополнительно к альбумину.
Таблица 1.7. Стадии ХБП и ХПН для детей и подростков
Примечание: ст.п. — стандартная поверхность (тела).
Определение белка в суточной моче долгое время было золотым стандартом для количественной оценки протеинурии. Альтернативным методом является измерение отношения белка или альбумина к креатинину в разовой порции мочи. Граничным является уровень в соотношении альбумин/креатинин свыше 30 мг/г у взрослых; данный показатель у детей и подростков представлен в табл. 1.8. Значение соотношения альбумин/креатинин > 300 мг/г у женщин и > 200 мг/г у мужчин соответствует терминам «макроальбуминурия» или клиническая протеинурия.
Таблица 1.8. Сравнение соотношения белок/креатинин и альбумин/креатинин мочи у детей и подростков
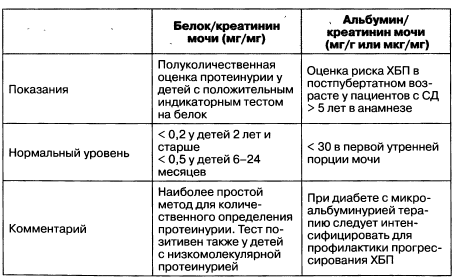
Эти отношения сглаживают колебания концентрации белка в моче при различных питьевых режимах, их определение удобнее в сравнении со сбором суточной мочи.
Гипертензия является одним из частых проявлений ХБП. Гипертензия может быть причиной ХБП, и наоборот, наличие ХПН всегда вызывает гипертензию de novo за счет развития гиперактивности симпатической системы и эритропоэтиндефицитной анемии (рис. 1.4, табл. 1.9).
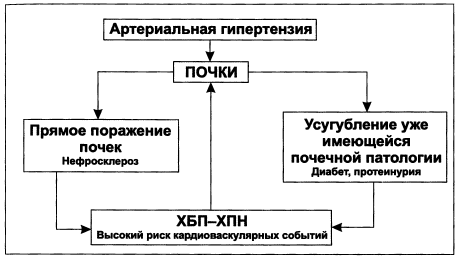
Рисунок 1.4. Взаимосвязь артериальной гипертензии и патологии почек
Таблица 1.9. Наличие гипертензии при хронической болезни почек
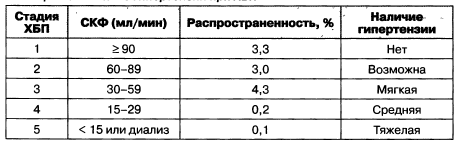
Примечание: гипертензия определена как АД > 140/90 мм рт.ст. или более 90 перцентилей у детей,
Артериальная гипертензия может приводить к нефросклерозу (рис. 1.5).
Формирование нефросклероза сопровождается возникновением компенсаторной гиперфильтрации, развивающейся в результате гиперактивности симпатической системы. Чем меньше размеры почек, тем выше активность симпатической системы. Именно поэтому симпатолитики являются эффективными в снижении АД и, к сожалению, их доза становится очень высокой при терминальной ХПН (рис. 1.6). Так, начальная доза моксонидина при ХПН составляет 0,2 мг 1—2 раза в сутки, а в предиализной стадии ХПН может достигать 0,4 мг до 4 раз в день.
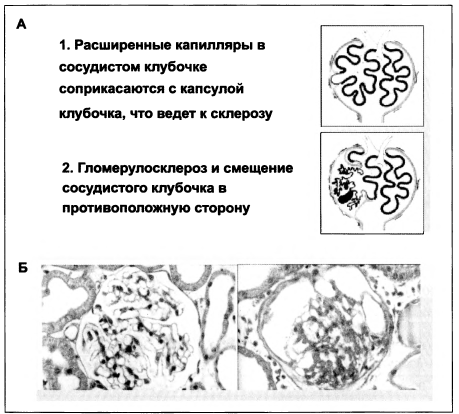
Рисунок 1.5. Развитие нефросклероза у пациентов с артериальной гипертензией: А — схема; Б — гистологический препарат
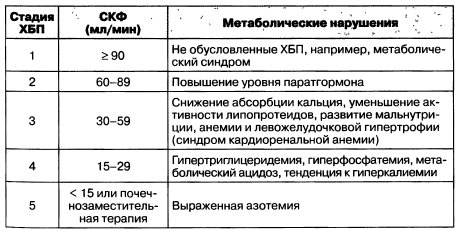
Следующим по частоте после гипертензии патологическим проявлением хронической болезни почек являются метаболические нарушения (табл. 1.10). Лечение пациентов с хронической болезнью почек требует анализа причинного заболевания и его активности, осложнений, сопутствующих состояний, риска потери функции почек и кардиоваскулярных событий.
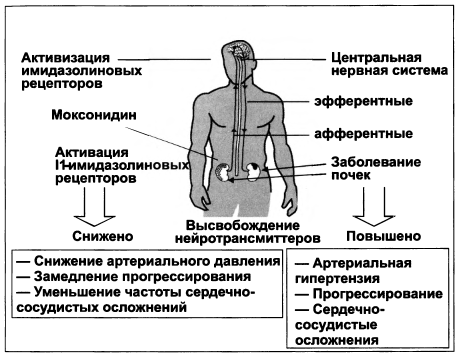
Рисунок 1.6. Значение активности симпатической нервной системы при ХПН
Таблица 1.10. Метаболические нарушения при различных стадиях ХБП
Лечение хронической болезни почек должно совмещать:
- Специфическую терапию, основанную на причинном диагнозе ХБП.
- Выявление и лечение сопутствующих состояний.
- Замедление потери функции почек.
- Профилактику и лечение сердечно-сосудистых болезней.
- Профилактику и лечение осложнений снижения функции почек (таких как гипертензия, анемия, ацидоз, задержка физического развития — для детей).
- Подготовку к терапии терминальной почечной недостаточности.
- Замещение функции почек путем трансплантации или диализа при терминальной ХПН.
С учетом стадии хроническая болезнь почек для каждого пациента должен быть разработан план клинических действий. При этом при каждом визите пациента следует индивидуализировать лечение:
- — для подбора доз исходя из СКФ;
- — выявления потенциальных неблагоприятных осложнений, обусловленных снижением СКФ;
- — определения взаимодействия лекарственных средств;
- — осуществления, при возможности, мониторинга содержания лекарств в организме.
В зависимости от установленной стадии ХБП предлагается следующая терапевтическая тактика (табл. 1.11).
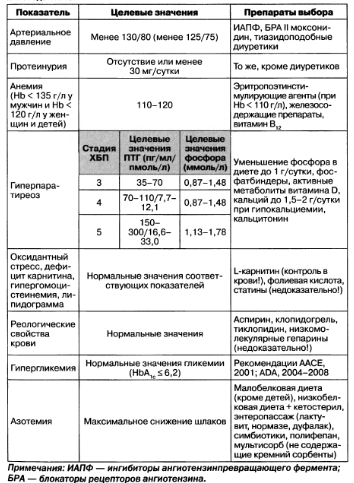
Терапевтическая тактика при ХБП и целевые значения важнейших показателей приведены в табл. 1.12.
Таблица 1.11. Тактика ведения хронической болезни почек в зависимости от стадии
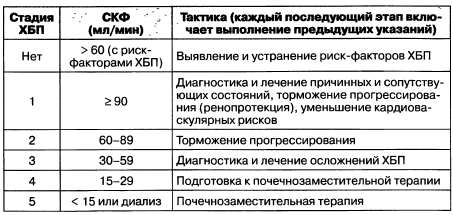
Таблица 1.12. Целевые значения показателей при хронической болезни почек
В лечении ХБП возможны три варианта событий:
1. Обратное развитие хронической болезни почек (вероятно, при рСКФ более 60 мл/мин).
2. Стабилизация хронической болезни почек со значимым удлинением додиализного периода.
3. Прогрессирование хронической болезни почек до диализной ХПН.
Пациенты с ХБП 1—4-й стадии имеют в 6-12 раз больший риск умереть, чем дожить до терминальной стадии. Среди пациентов с 3-й стадией ХБП в пятилетнем наблюдении, к сожалению, погибает каждый четвертый (рис. 1.7). При этом риск смерти от кардиоваскулярных событий выше риска прогрессирования патологии до терминальной ХПН. Риск развития сердечно-сосудистых осложнений возникает при снижении СКФ до уровня менее 90 мл/мин и сохраняется, несмотря на коррекцию других кардиоваскулярных рисков, т.е. является независимым от ХПН. Практическим выводом является то, что модификация образа жизни, призванная снижать повышенное АД, не является достаточной для безмедикаментозного ведения пациентов с ХБП. Что наиболее часто приводит к смерти пациентов? Ответ на этот вопрос представлен в исследовании НОТ (табл. 1.13, рис. 1.8).
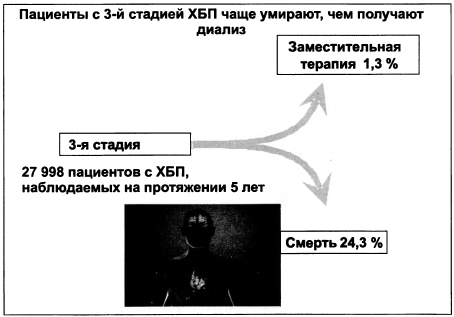
Рисунок 1.7. Уровень смертности пациентов с 3-й стадией ХБП
Таблица 1.13. Зависимость частоты осложнений от повышенного креатинина крови

Таким образом, в наблюдении и лечении пациентов с хронической болезнью почек одновременно решаются две задачи: сохранение СКФ и профилактика/лечение кардиоваскулярных осложнений. При этом последние имеют большее прогностически негативное влияние на длительность жизни пациента с ХБП (рис. 1.8). Рекомендации ESC 2006 г. для подтверждения диагноза кардиоваскулярного поражения и сердечной недостаточности изначально предлагают использовать неинвазивные методы, как-то: ЭКГ с физической нагрузкой, стресс-Эхо или перфузионную миокардиальную сцинтиграфию. Очевидно, эти методы могут быть имплементированы для пациентов с ХБП для оценки риска кардиоваскулярных событий.
Таким образом, при подборе препаратов для антигипертензивной терапии и ликвидации протеинурии (с целью замедления прогрессирования ХБП) следует учитывать необходимость профилактики развития кардиоваскулярных событий.

Рисунок 1.8. Поражения почек, сопровождающиеся кардиоваскулярными рисками
