Глава 11. Группа пестицидов
Токсикологическая химия Вергейчик Т.Х.
11.1. Общая характеристика пестицидов
11.2. Химико-токсикологическое значение и анализ хлорорганических пестицидов
- 11.2.1. Гексахлорциклогексан (ГХЦГ)
- 11.2.2. Гептахлор
- 11.2.3. Токсикологическое значение других хлорорганических пестицидов
11.3. Химико-токсикологическое значение и анализ фосфорсодержащих пестицидов
- 11.3.1. Характеристика некоторых фосфорсодержащих пестицидов
- 11.3.2. Методы изолирования и обнаружения фосфорсодержащих пестицидов
- 11.3.3. Методы количественного определения фосфорорганических пестицидов
11.4. Химико-токсикологическое значение и анализ эфиров карбаминовой кислоты
11.5. Химико-токсикологическое значение и анализ пиретроидов
11.6. Неорганические ядохимикаты и органические препараты ртути
- 11.6.1. Гранозан (этилмеркурхлорид)
- 11.6.2. Фториды и кремнефториды
- 11.6.3. Фосфид цинка
11.1 Общая характеристика пестицидов
Пестициды (от лат. pestis — «зараза» и caedo — «убивать») или ядохимикаты составляют большую группу соединений, являющихся главной причиной профессиональных отравлений в сельской местности. Чаще всего подвергаются токсическому воздействию лица, непосредственно соприкасающиеся с ними — работники сельского хозяйства, специалисты в области химической промышленности, производящей данные вещества. Пестициды являются одной из причин «токсической ситуации» в мире, так как они наряду с непосредственным воздействием на живой организм проникают в растения, в почву, в воду и т.п. Поэтому источниками отравления людей и животных могут быть не только сами пестициды, но и различные объекты внешней среды, растения, пищевые продукты и т.п. Отдельные пестициды длительное время сохраняются во внешней среде, в организме теплокровных животных, поедающих обработанные ядохимикатами растения, и могут попадать в организм человека с молоком, мясом указанных животных.
В организме человека и теплокровных животных пестициды подвергаются различным превращениям. Продукты их превращения — метаболиты — выводятся из организма с мочой, калом. Образующиеся метаболиты в некоторых случаях являются более токсичными, чем сами пестициды.
Внимание пестицидам как группе токсикологически важных объектов стало уделяться в 1950-е годы, особенно с началом войны во Вьетнаме, когда массированное использование хлорорганических гербицидов привело к массовым заболеваниям людей. В этот период начались активные исследования по изучению токсичности различных классов пестицидов и разработке методов их анализа в биологических объектах.
В настоящее время ситуация не смягчается, а обостряется. Для повышения урожайности и сохранения сельскохозяйственных продуктов требуются все более эффективные пестициды. Это означает, что их токсичность для людей и опасность для окружающей среды будут постоянно возрастать. Следует отметить, что в настоящее время действующим органом, осуществляющим контроль за качеством применяемых и разрабатываемых пестицидов, является санэпиднадзор, который работает в тесном контакте с химиками и токсикологами. Благодаря деятельности санэпиднадзора к пестицидам предъявляются требования по ограничению длительности сохранения в окружающей среде (персистентность). Для большинства пестицидов установлены нормы предельно допустимых концентраций (ПДК) в окружающей среде, пищевых продуктах, Зерновых, плодовых, овощных культурах и др., а также правила техники безопасности при работе с ними. Однако химико-токсикологический анализ биологических объектов — это задача химиков.
Принципы классификации пестицидов
Классификация имеет прикладное значение для каждого специалиста. С точки зрения специалиста-аграрника, классификация пестицидов проводится по принципу воздействия на вредные растения, грибы, насекомые, грызунов и т.д. С точки зрения химика классификация проводится по принципу химического строения, который позволяет унифицировать методы изолирования и анализа пестицидов. Для токсикологов, медицинских работников важна классификация по токсичности используемых соединений. Ознакомимся с принятыми классификациями пестицидов.
По воздействую на живой организм и растения пестициды делят на следующие группы:
- препараты, действующие на траву, кустарники, водоросли, — гербициды, арбори- циды, альгициды;
- препараты, действующие на грызунов, диких животных, хищников, — зооциды, родентициды;
- препараты, действующие на насекомых, — инсектициды, акарициды;
- препараты для борьбы с червями, моллюсками — нематоциды, лимациды;
- препараты для борьбы с заболеваниями растений — фунгициды, бактерициды. Имеется группа препаратов, используемых для стимулирования роста растений, для подсушивания или удаления листвы и т.д.
По химическому строению пестициды делят на следующие основные группы:
- хлорорганические соединения;
- фосфорсодержащие пестициды;
- производные карбаминовой кислоты;
- синтетические пирегроиды;
- неорганические пестициды;
- органические соединения ртути и др.
По токсичности пестициды делятся на четыре группы:
- высокотоксические пестициды, LDS0 составляет до 50 мг/кг веса животного;
- сильнодействующие (токсичные) пестициды, LDS0 находится в пределах 50-200 мг/кг;
- пестициды средней токсичности, LD50 составляет 200-1000 мг/кг;
- малотоксичные соединения, LD50 выше 1000 мг/кг.
В организм насекомых инсектициды могут проникать несколькими путями. В зависимости от этого они подразделяются на 4 основные группы: контактные, проявляющие действие при соприкосновении с любой частью тела насекомого; кишечные, оказывающие вредное воздействие после попадания их через органы пищеварения и кишечник; системные, попадающие в организм насекомого после поедания обработанных ими растений; фумиганты, попадающие в организм через дыхательные пути.
Гербициды по избирательности действия на растения подразделяют на гербициды сплошные, пагубно действующие на все виды растений, и избирательные (селективные), действующие только на один или ограниченное число видов растений. Гербициды по характеру действия подразделяются на гербициды контактного действия, поражающие растения при непосредственном контакте с листьями и стеблями растений, гербициды системного действия, которые проникают в сосудистую систему растений и вызывают их гибель, и гербициды, действующие на корневую систему растений или на прорастающие семена. Основными формами применения пестицидов являются порошки (дусты), концентраты эмульсий, гранулы, аэрозоли.
В токсикологической химии при исследовании пестицидов используется химическая классификация.
11.4 Химико-токсикологическое значение и анализ эфиров карбаминовой кислоты
В настоящее время синтезировано большое количество эфиров карбаминовой кислоты (карбаматов). В сельском хозяйстве нашли применение немногие из них. Токсикологическое значение из этой группы веществ имеет севин или карбарт.
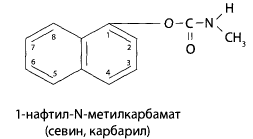
Севин — это белое кристаллическое вещество, малорастворимое в воде, растворимо в большинстве органических растворителей. Он выпускается в виде 50-85% порошка (дуста) или гранул. Применяется как высокоэффективный инсектицид широкого спектра действия для борьбы с вредителями сельскохозяйственных культур и деревьев.
Токсическое действие севина выражено слабо. Он обладает умеренной токсичностью и медленно накапливается в организме. В основе токсического действия лежит торможение активности холинэстеразы, нарушение синтеза биогенных аминов. Севин оказывает неблагоприятное действие на паренхиматозные органы, эндокринную систему, генеративную функцию организма, обладает эмбриотоксическим, тератогенным и мутагенным действием. Описаны отравления средней тяжести при приеме внутрь 250 мг препарата. Смертельные отравления наблюдались в случае приема внутрь 0,5 л 80% суспензии. При смертельных отравлениях наблюдается отек легких.
Метаболизм севина. При пероральном поступлении севин быстро проникает в различные органы. В результате ферментативного гидролиза эфирной связи (преимущественно в крови и печени) образуются 1-нафтол и N-метилкарбаминовая кислота, которая затем распадается на метиламин и оксид углерода(1У). Метиламин подвергается окислительному деметилированию.
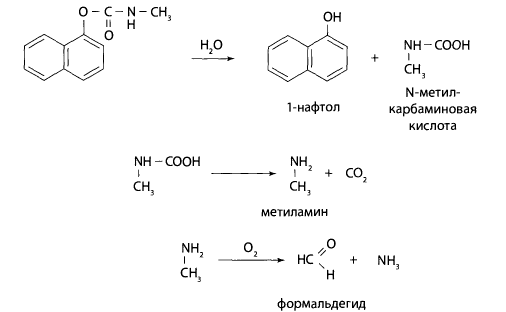
Продукты метаболизма оксид углерода, формальдегид и 1-нафтол из организма выводятся различными путями.
1-нафтол образует конъюгаты с серной и глюкуроновой кислотами и выделяется с мочой.
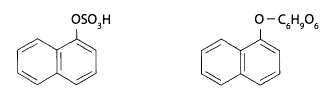
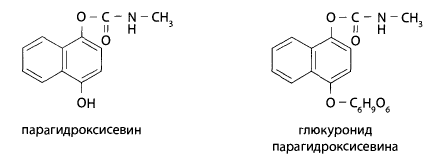
Кроме того, севин может в организме присоединять в параположении гидроксильную группу, а затем конъюгироваться с глюкуроновой кислотой.
Предварительное исследование объекта на карбаматы
Реакция с фурфуролом. К 1 мл исследуемого объекта (содержимого желудка) добавляют 0,5 мл разбавленной хлороводородной кислоты и экстрагируют 4 мл хлороформа. Хлороформный экстракт выпаривают досуха. Остаток растворяют в 0,1 мл метилового спирта и раствор наносят на фильтровальную бумагу. После подсушивания на пятно наносят 0,1 мл фурфурола и снова подсушивают. Фильтровальную бумагу выдерживают в течение 5 мин над концентрированной хлороводородной кислотой. При наличии производных карбаминовой кислоты пятно окрашивается в черный цвет.
Изолирование севина и его основного метаболита 1-нафтола проводится бензолом. Навеску биоматериала массой 100 г заливают 100 мл бензола, периодически помешивают в течение часа. Затем бензол сливают и экстрагирование повторяют еще дважды (по 100 мл). Бензольные вытяжки объединяют, фильтруют и отгоняют бензол на водяной бане до небольшого объема. Остаток выпаривают под вытяжным шкафом при комнатной температуре досуха. Полученный остаток растворяют в 10 мл спирта. При получении окрашенного в желто-бурый цвет остатка его подвергают очистке. С этой целью к сухому остатку добавляют смесь из 20% раствора аммиака, концентрированной фосфорной кислоты и ацетона 3:2:5. Для удаления ацетона жидкость нагревают на водяной бане при 40°С. Затем охлажденный раствор экстрагируют трижды 20 мл хлороформа. Хлороформные вытяжки объединяют, выпаривают на водяной бане досуха, остаток растворяют в 5 мл этилового спирта. В полученном растворе будут находиться севин и 1-нафтол.
Обнаружение севина. Севин гидролизуют до 1-нафтола и проводят реакции с 4-аминофеназоном, хлоридом меди и бромидом калия, с хлоридом железа(Ш), с нитритом натрия. Для обнаружения севина используют также хроматографию в тонком слое сорбента и микрокристаллоскопические реакции.
Реакция с 4-аминофеназоном. В пробирку вносят 1 мл спиртового раствора, полученного после изолирования, и 0,5 мл аммиачной буферной смеси (растворяют 10 г хлорида аммония в 50 мл 25% раствора аммиака). Пробирку нагревают на водяной бане при температуре 55-60°С (с воздушным холодильником) в течение 15 мин. После охлаждения добавляют три капли 0,5% водного раствора 4-аминофеназона и 6 капель 10% водного раствора гексацианоферрата(Ш) калия — появляется оранжево-красное окрашивание
Реакция с хлоридом меди и бромидом калия. В пробирку вносят 1 мл спиртового раствора полученного после изолирования, 0,4 мл 0,5 М раствора гидроксида натрия и нагревают на водяной бане в течение 10 мин при 55°С (с воздушным холодильником). После охлаждения добавляют 0,5 М хлороводородную кислоту до рН=5-6 и 1 мл свежеприготовленной смеси, содержащей 0,1 г хлорида меди(П), 4 г бромида натрия и 5,9 мл воды очищенной. При нагревании смеси до 60°С раствор окрашивается в красно-фиолетовый цвет. При взбалтывании с хлороформом окрашенное соединение переходит в слой хлороформа.
Реакция с хлоридом железа(Ш). При добавлении к спиртовому раствору капли 1% раствора хлорида железа(ПГ) появляется розовое окрашивание.
Реакция с нитритом натрия. При добавлении к спиртовому раствору 0,5% раствора нитрита натрия и разбавленной серной кислоты образуется желтое окрашивание, которое переходит в оранжевое при добавлении гидроксида натрия.
Реакция с пикриновой кислотой. На предметное стекло наносят 1 каплю исследуемого раствора и испаряют досуха. К остатку добавляют 1 каплю раствора пикриновой кислоты. Через 10-15 мин появляются темно-желтые кристаллы, собранные в пучки. При малом содержании севина кристаллы образуются очень медленно (рис. 98).
Реакция перекристаллизации. Из спиртового раствора севин кристаллизуется (рис. 99) при испарении растворителя в виде характерных сростков кристаллов (крестов и дендритов).
Обнаружение севина и 1-нафтола методом ТСХ. На пластинку с закрепленным слоем оксида алюминия наносят каплю спиртового раствора остатка извлечения из объекта и — в качестве «стандартов» — растворы севина и 1 -нафтола. Пластинку помещают в систему растворителей хлороформ — бензол — ацетон (7:2:1). После хроматографирования и высушивания пластинки на воздухе ее облучают УФ-лампой. При наличии севина или 1 -нафтола их пятна флуоресцируют. Затем пластинку опрыскивают щелочным раствором диазотированной сульфаниловой кислоты. При этом пятна на пластинке приобретают красное окрашивание.

Количественное определение. Для количественного определения севина используют фотоколориметрический метод. Он основан на омылении севина до 1-нафтола и получении окрашенного соединения с хлоридом меди и бромидом калия (купробромидом) по описанной в разделе «обнаружение севина» методике. Окрашенный в краснофиолетовый или сине-фиолетовый цвет слой хлороформа отделяют и в полученном растворе регистрируют оптическую плотность с помощью фотоколориметра при 420 нм (синий светофильтр) в кювете с толщиной слоя 1 см. Расчет содержания севина в исследуемом объекте ведут по калибровочному графику.
11.5 Химико-токсикологическое значение и анализ пиретроидов
В этой группе рассматриваются инсектициды, которые являются синтетическими аналогами природных пиретринов. Эти соединения обладают широким спектром действия, эффективны при очень малых нормах расхода — 16-300 г на один гектар. Их используют для обработки хлопчатника и многих других культур и садов. В настоящее время известны три поколения пиретроидов.
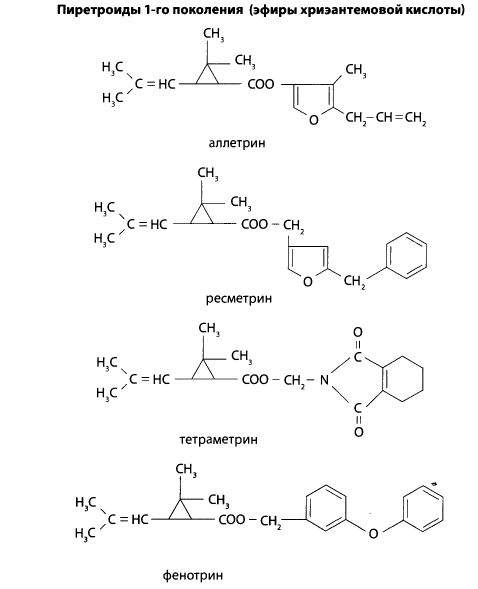
Пиретроиды 2-го поколения — эфиры 3-(2,2-дигалогенвинил)- 2,2-диметилциклопропанкарбоновой кислоты
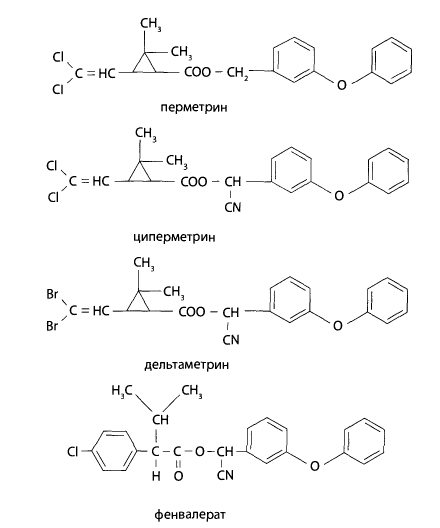
Недостатком пиретроидов 1-го и 2-го поколения является высокая токсичность для пчел и рыб и непригодность для почвообитающих насекомых.
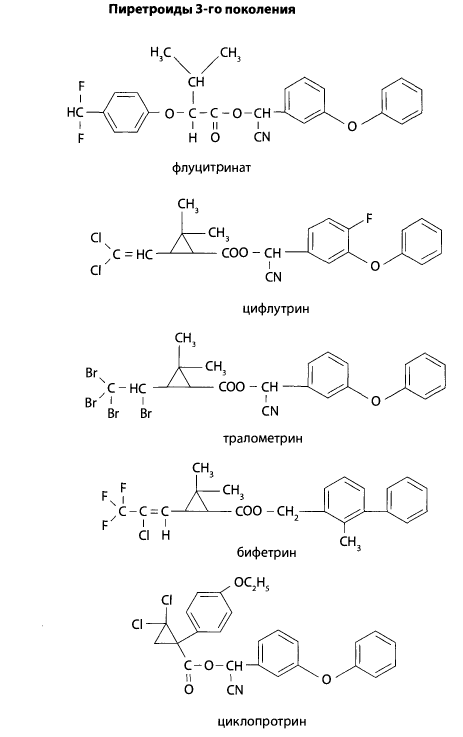
Предложенные пиретроиды третьего поколения обладают большей активностью в отношении клещей и меньшей токсичностью в отношении пчел, птиц и рыб. Кроме указанных соединений, применяются в практике еще более 100 синтетических пиретроидов.
Физико-химические свойства синтетических пиретроидов. Синтетические пиретроиды — это кристаллические, жидкие, пасто- и воскообразные вещества. Они летучи в разной степени, являются веществами нейтрального характера, хорошо растворимы в большинстве органических растворителей (ацетоне, гексане, хлороформе, ацетонитриле и др.) и плохо растворимы в воде. Промышленностью синтетические пиретроиды выпускаются в виде смачиваемых порошков или паст. Под действием кислорода, влаги и света разлагаются. Они устойчивы в слабокислой и нейтральной средах, но как эфиры гидролизуются под действием щелочей и сильных кислот. Например, дельтаметрин при перегонке способен гидролизоваться с образованием синильной кислоты, которая может быть обнаружена в дистилляте.
В организм человека пиретроиды могут поступать через легкие и ЖКТ. В организме теплокровных, в частности человека, синтетические пиретроиды подвергаются гидролизу, а затем гидроксилированию. При наличии цианогруппы она подвергается трансформированию в тиоцианогруппу. Пиретроиды являются липофильными соединениями.
Токсикологическое значение. Смертельная доза большинства пиретроидов для человека не установлена. Все пиретроиды — яды нервного типа, они поражают центральную и периферическую нервную систему. При контакте с пиретроидами токсическое действие выражается в раздражении кожи в виде зуда, жжения, эритем. Затем появляются головная боль, головокружение, боли в суставах, тошнота, рвота, поражение печени. Позже проявляется нейротоксическое действие, тремор, судороги, параличи, мышечная слабость, глубокая депрессия. При высоких концентрациях наблюдается поражение нервных окончаний. Синтетические пиретроиды влияют на активность холинэстеразы и окислительновосстановительные системы организма подобно действию севина. Смертельные случаи проявляются в виде инфаркта. По токсичности синтетические пиретроиды значительно отличаются друг от друга: от сильно токсичных (LDS0=25 мг/кг) до малотоксичных (LD50=10 ООО мг/кг).
При вскрытии погибших наблюдаются отек мозга, дистрофические изменения в паренхиматозных органах, кровенаполнение печени.
Методы изолирования пиретроидов
Изолирование из трупного материала. Как вещества органической природы нейтрального характера пиретроиды экстрагируются эфиром или хлороформом из растворов с рН=2-3. Преимущество отдается обычно изолированию спиртом. Из биологического материала спиртом способны извлекаться не только нативные соединения, но и полярные продукты метаболизма пиретроидов.
При направленном анализе в качестве экстрагентов предлагается использовать гексан, петролейный эфир или смесь гексана и ацетона в соотношении 9:1 или 7:3. Эти экстрагенты позволяют извлекать меньшее количество соэкстрактивных веществ.
Для очистки извлечений из трупного материала используют реэкстракцию или колоночную хроматографию.
Экстракционный метод очистки. Сухой остаток после испарения экстракта из объекта растворяют в 25-30 мл гексана и несколько раз экстрагируют ацетонитрилом. К ацетонитрильным вытяжкам добавляют 5-10% растворы хлорида натрия или калия и затем вновь проводят экстракцию пиретроидов гексаном.
Колоночная хроматография. Для цели очистки извлечений используют колонки диаметром 1 см и длиной 10 см со слоем силикагеля КСК, на который сверху помещают 2 г безводного сульфата натрия. Хлороформный экстракт упаривают до объема 5 мл и пропускают через колонку со скоростью 40-50 капель в минуту. Синтетические пиретроиды элюируют с колонки 96% этанолом.
Изолирование синтетических пиретроидов из крови и мочи. Для изолирования предложена твердофазная экстракция. 1 мл плазмы крови или мочи разбавляют 10 мл 70% раствора метанола (часть белков плазмы при этом осаждается). В качестве сорбента используют ненабухающие модифицированные силикагели, обладающие свойством с высокой скоростью устанавливать сорбционное равновесие. Разбавленную метанолом плазму (мочу) пропускают через патрон с сорбентом. Пиретроиды с колонки элюируют смесью метанол — вода (30:70).
Анализ извлечений. Наиболее эффективными методами обнаружения пиретроидов являются методы ТСХ, ГЖХ, ГХ/МС и иммунохимический анализ.
При проведении хроматографии в тонком слое сорбента используют пластинки «Сорбфил», пластинки со слоем силикагеля или оксида алюминия. В качестве систем рекомендуются 2- и 3-компонентные смеси на основе гексана, хлороформа, толуола с добавлением полярных и неполярных растворителей (ацетона, бензола, диэтилового эфира, этилацетата и др.). Чаще всего применяют системы хлороформ — метанол — 25% раствор аммиака (32:7:1) или гексан — ацетон (4:1).
Для обнаружения синтетических пиретроидов на пластинках используют следующие способы:
• Облучение УФ-лампой. Наблюдают флуоресцирующие пятна.
- При обработке 0,3% раствором перманганата калия и при последующем нагревании образуются пятна светло-желтого цвета.
- При обработке пластинки аммиачным раствором нитрата серебра в ацетоне и облучении в течение 10-15 мин УФ-лучами наблюдают серо-черные пятна пиретроидов Обнаруживаются все соединения данной группы веществ, содержащие галоген.
- При обработке пластинки фосфорномолибденовой кислотой и этиловым спиртом с последующим нагреванием пиретроиды образуют серо-желтые пятна.
- При обработке пластинки реактивом Драгендорфа (в модификации Мунье) пиретроиды обнаруживаются в виде оранжевых пятен (на пластинках «Сорбфил»).
- При обработке пластинки парами брома, а затем о-толидином в ацетоне образуются синие пятна галогенсодержащих пиретроидов.
- При обработке пластинки модифицированным реактивом Дениже (оксид ртути(П), вода и концентрированная серная кислота) производные хризантемовой кислоты образуют пятна розового цвета.
- Пиретроиды, содержащие группу CN, при обработке пластинки 20% раствором гидроксида натрия, 1% раствором ацетата меди(Н) и 1% раствором о-толидина в 10% растворе уксусной кислоты образуют пятна синего цвета.
Для некоторых пиретроидов, содержащих атомы серы, кислорода, азота, пластинку обрабатывают бромфеноловым синим в присутствии ацетона и серебра. Общий фон на пластинке обесцвечивают обработкой 2% раствором лимонной кислоты. Пиретроиды проявляются в виде синих пятен.
Более эффективным является метод ГЖХ, так как многие пиретроиды являются летучими соединениями. Идентификацию пиретроидов проводят по времени или объему удерживания. Газожидкостная хроматография используется после очистки экстрактов из биологических объектов. Иногда, чтобы увеличить летучесть препаратов перед обнаружением, их дериватизируют. Часто рекомендуется проводить гидролиз препаратов с последующим получением метиловых эфиров продуктов гидролиза, которые и подвергают анализу. Используют приборы с детекторами ПИД, ДЭЗ. Колонки обычно набивные или капиллярные кварцевые. Неподвижные жидкие фазы неполярные или слабополярные. Режим работы прибора чаще всего изотермический с программированной температурой.
Единой методики анализа с помощью ГЖХ для синтетических пиретроидов нет. Имеющиеся разработки касаются отдельных производных. Делаются попытки разработки скрининговых методов для анализа пиретроидов.
Метод хроматомасс-спектрометрии используется в качестве арбитражного и требует тщательной очистки извлечений. Он включает использование высокоселективного детектора. Наибольшее распространение при анализе синтетических пиретроидов получил метод ионизации молекул электронным ударом и реже — метод химической ионизации. Основной путь фрагментации молекул пиретроидов заключается в разрыве сложноэфирной связи. Например, для идентификации пиретроидов при проведении анализа методом ГХ-МС с помощью электронного удара выделены следующие ионы:
- соответствующие кислой части молекулы (остатки хризантемовой или циклопро- панкарбоновой кислот) -m/z 97, 123, 163, 167, 251;
- соответствующие спиртовой части молекулы — m/z 164, 171, 183, 208, 209, 181;
- альдегид хризантемовой кислоты — m/z 151;
- анион хризантемовой кислоты — m/z 167 и т.д.
Полученные масс-спектры сравниваются с результатами анализа стандартных образцов или с библиотекой масс-спектров.
Количественное определение синтетических пиретроидов
Для количественного определения пиретроидов предложены различные методы, но чаще всего используют:
Метод ГЖХ по высоте или площади пика с использованием внутреннего стандарта Метод денситометрии. Проводится на хроматографических пластинках после получения окрашенных пятен. С помощью специальных сканирующих устройств определяют площадь пятна и рассчитывают концентрацию пиретроида, используя стандартные образцы.
