ГОРМОНЫ. ОБЩИЙ МЕХАНИЗМ ДЕЙСТВИЯ ГОРМОНОВ
Гормоны — это класс регуляторных молекул, синтезируемых специальными клетками.
Особенности биологического действия: 1) низкая концентрация в крови (10–6–10–12 М);
2) обязательная связь с рецептором – (R), включающим каскадный механизм усиления гормонального сигнала; 3) изменение скорости синтеза ферментов или их активности; 4) регуляция секреции по принципу прямой и (или) обратной связи.
Взаимодействие гормона и (R) характеризуется высокой специфичностью, которая обеспечивается комплементарностью между структурой гормона и активного центра (R).
В результате эффекта кооперативности, возникающего при взаимодействии гормона и (R), существенно изменяется активность (R) — это есть феномен амплификации (усиления) гормонального сигнала. Механизм амплификации включает участие специальных ферментов и молекул — вторичных посредников. Гормональный сигнал способен «выключаться» в результате инактивирования (R) путём его фосфорилирования, либо удаления (R) с поверхности клетки (эндоцитоз) и т. д. Множество разных сигналов, воспринимаемых клеткой, суммируется в один определённый ответ.
Клеточные (R) в зависимости от их локализации делятся на 2 большие группы: 1) (R) плазматической мембраны; и 2) внутриклеточные (R).
(R) плазматической мембраны клеток обеспечивают узнавание, связывание и передачу регуляторного сигнала внутрь клетки. Среди них различают:
1. 7-ТМС-(R) — это интегральные мембранные белки с семью трансмембранными спиральными сегментами, соединенными гидрофильными внеклеточными и внутриклеточными петлями. Внутриклеточные петли этих (R) содержат центры связывания G-белка.
2. 1-TMС-(R) — это интегральные мембранные белки с одним трансмембранным сегментом и глобулярными доменами на вне- и внутриклеточной поверхностях мембраны. Внеклеточный домен содержит участок узнавания и связывания гормона, а внутриклеточный обладает каталитической активностью. Когда (R) активируется гормоном, его внутриклеточный домен катализирует образование внутриклеточных вторичных посредников.
3. Каналообразующие (R) — состоят из белковых субъединиц, каждая из которых содержит несколько трансмембранных сегментов.
Внутриклеточные (R) расположены в цитозоле или ядре клетки. После связывания с гормоном они изменяют скорость транскрипции и трансляции определённых генов.
По химической природе гормоны делят на:
- пептиды (глюкагон, котрикотропин) и белки (сложные белки — тиреотропин, гонадотропины; простые белки — соматотропин, инсулин);
- производные аминокислот (адреналин, серотонин, тироксин);
- стероиды (альдостерон, кортизол, половые гормоны, витамин Д и ретиноевая кислота);
- производные липидов (эйкозаноиды).
Механизм действия гормонов, взаимодействующих
с 7-ТМС-рецепторами
Первый этап действия гормона заключается во взаимодействии гормона с 7-ТМС-(R) (к ним относятся α- и β-адренергические (R), (R) гистамина, серотонина, соматостатина, гликопротеиновых гормонов, глюкагона, паратирина, кальцитонина, гормонов гипоталамуса).
Второй участник передачи гормонального сигнала —
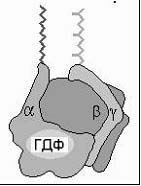
G-белки. Обнаружены: 1) большие, состоящие из нескольких субъединиц G-белки (связаны с мембранами); 2) низкомолекулярные, состоящие из одной полипептидной цепи (цитозольные). Все G-белки обладают ГТФ-азной активностью, и их конформация зависит от того, связаны ли они в данный момент с ГДФ или ГТФ. Мембранный G-белок состоит из 3 субъединиц: α, β и γ.
В неактивном состоянии три субъединицы соединены вместе, и α-субъединица связана с ГДФ. После присоединения гормона к 7-ТМС-(R) и взаимодействия гормон-рецепторного комплекса с G-белком в последнем происходит замена ГДФ на ГТФ, вследствие чего G-белок диссоциирует с образованием свободной α-субъединицы и димера субъединиц β, γ. Затем
α-субъединица перемещается по мембране и взаимодействует с мембраносвязанными ферментами (аденилатциклазой или фосфолипазой С), катализирующими образование низкомолекулярных вторичных посредников. Продолжительность эффекта G-белка определяется ГТФ-азной активностью его α-субъединицы: после гидролиза ГТФ до ГДФ действие субъединицы прекращается и G-белок возвращается в исходное тримерное состояние
Аденилатциклаза. Различные типы аденилатциклаз реагируют с α-субъединицами, выполняющими разные функции: если связывание осуществляется с αs-субъединицей
G-белка, то фермент активируется, если с αI—cубъединицей, то ингибируется. Аденилатциклаза катализирует образование цАМФ из АТФ. Уровень цАМФ в клетках очень низок, но при активировании аденилатциклазы он может быстро и значительно увеличиваться. Однако это повышение кратковременно. Распад цАМФ катализируется цАМФ-фосфодиэстеразами (ФДЭ), гидролизующими фосфодиэфирную связь в молекуле цАМФ. ФДЭ — регулируемый фермент (его ингибирует кофеин, что приводит к повышению уровня цАМФ).
цАМФ является аллостерическим регулятором протеинкиназы А (существуют разные типы этих ферментов). Протеинкиназы — это гетеромеры, состоящие из двухкаталитических и одной регуляторной субъединиц. Присоединение цАМФ к регуляторной субъединице высвобождает каталитические субъединиц. Последние переносят фосфорный остаток с АТФ на серин или треонин некоторых ферментов, которые при этом переходят в активное или неактивное состояние (это зависит от свойств данного фермента: так, фосфорилирование гликогенфосфорилазы активирует ее, а фосфорилирование гликогенсинтазы её угнетает). цАМФ регулирует также открытие цАМФ-зависимых ионных каналов. Повышение уровня цАМФ может приводить к активации транскрипции определенных генов.
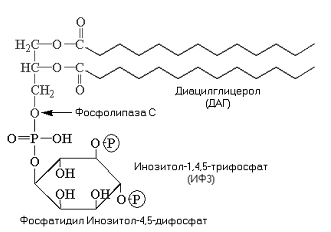
Фосфолипаза С. Субстратом этого фермента является фосфатидилинозитол-4,5-дифосфат. Фосфолипаза С катализирует образование двух мощных вторичных посредников: диацилглицерола (ДАГ) и инозитол—1,4,5-трифосфата (ИТФ).
ИТФ связывается с (R) кальцисом, что приводит к открытию лиганд-зависимых кальциевых каналов кальцисом. В результате в цитозоле резко увеличивается концентрация Са2+. Высвободившийся Са2+ захватывается специальными кальций-связывающими белками, например, калмодулином. Когда уровень внутриклеточного Са2+ повышается, кальций-калмодулиновый комплекс присоединяется к различным белкам-мишеням, что сопровождается изменением их активности. Кальмодулин-зависимые протеинкиназы регулируют активность многих ферментов. Они также способны проникать в ядро клетки, где фосфорилируют белки, ответственные за активацию транскрипции.
Таким образом, ИТФ повышает концентрацию Са2+ в цитозоле. ДАГ остается в плазматической мембране и либо гидролизуется с образованием арахидоновой кислоты (необходимой для синтеза простагландинов), либо активирует протеинкиназу С. При низком внутриклеточном уровне Са2+ и отсутствии ДАГ протеинкиназа С находится в цитоплазме в неактивном состоянии. При связывании ДАГ конформация протеинкиназы С изменяется, увеличивается её сродство к Са2+ и она начинает активировать разнообразные белки-мишени (так, С-киназа фосфорилирует и тем самым активирует Na+/H+ обменный насос плазматической мембраны, контролирующий внутриклеточный рН). Активная С-киназа способна усиливать транскрипцию генов.
Механизм действия гормонов, взаимодействующих
с 1-ТМС-рецепторами
К 1-TMС-(R) относятся гуанилатциклазы, катализирующие образование цГМФ из ГТФ. Первый тип гуанилатциклаз, локализующийся в плазматической мембране, активируется внеклеточными лигандами (предсердным натрийуретическим фактором); второй —цитозольный фермент, активируемый оксидом азота (NO۬). Оксид азота вызывает расслабление гладкой мускулатуры сосудов, в том числе коронарных.
Гормон, присоединившись к 1-TMС-(R), его активирует. Этот гормон-рецепторный комплекс проявляет гуанилатциклазную активность, катализируя образование цГМФ из ГТФ. цГМФ (вторичный посредник) активирует протеинкиназу С, которая начинает фосфорилировать остатки Сер и Тре в белках-мишенях, что приводит эти белки в функционально активное состояние. цГМФ является также активатором фосфодиэстераз, катализирующих распад цАМФ (т. е. цГМФ и цАМФ – антагонисты). Конечный эффект цГМФ проявляется в изменении транспорта ионов и воды в почках и кишечнике; в сердечной мышце цГМФ способствует мышечному расслаблению; в палочках и колбочках сетчатки глаза цГМФ стимулирует открытие ионных каналов.
Самой распространённой группой 1-TMС-(R) являются рецепторные тирозинкиназы. В их структуре имеется 4 домена: внеклеточный (связывает гормон), трансмембранный, внутриклеточный с тирозинкиназной активностью, внутриклеточный регуляторный. Важнейшей тирозинкиназой является (R) инсулина. Присоединение инсулина вызывает аутофосфорилирование киназного домена (R). При этом ускоряется фосфорилирование остатков тирозина в особом белке — IRS-1 (инсулин-рецепторный субстрат). Активный IRS-1 включает целый каскад реакций, усиливающих гормональный сигнал. Это протеинкиназные реакции с участием, в первую очередь, МАП-киназ (митоген-активируемые протеинкиназы). МАП-киназы изменяют активность многих ферментов путём их фосфорилирования.
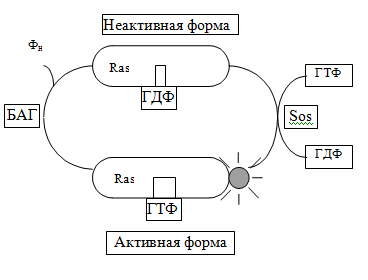
В передаче сигнала с участием 1-TMС-(R) есть свои выключатели. Это Ras-белки, относящиеся к семейству мономерных ГТФ-аз. Ras-белки могут быть активными, если к ним присоединяется ГТФ, и становиться неактивными при замене ГТФ на ГДФ. Однако Ras-белки катализируют гидролиз ГТФ очень медленно. Существует специальный белок, ускоряющий гидролиз ГТФ, — БАГ
(белок, активирующий ГТФ-азу). Другой специальный белок — SOS-белок (фактор, высвобождающий гуаниловые нуклеотиды) — препятствует этому гидролизу, заменяя ГДФ на ГТФ, поэтому он оказывает активирующий эффект на Ras-белок.
Механизм действия гормонов, взаимодействующих
с внутриклеточными (R)
Витамин Д, ретиноевая кислота, стероидные и тиреоидные гормоны взаимодействуют непосредственно с внутриклеточными (R), поскольку они, будучи гидрофобными, свободно диффундируют через плазматическую мембрану. Эти рецепторы делятся на:
1) (R) стероидных гормонов (минералокортикоидов, андрогенов, прогестерона); 2) (R) тиреоидных гормонов (в том числе витамина Д и ретиноевой кислоты).
(R) стероидных гормонов находятся в цитозоле. Они образуют комплексы с белками теплового шока hsp (heat shock proteins), которые присоединяются к (R) таким образом, что закрывают его ДНК-связывающий домен. Кода гормон взаимодействует с (R), то белок-ингибитор hsp отделяется от (R), в результате чего (R) активируется. Активированный гормон-рецепторный комплекс перемещается в ядро, где он взаимодействует со строго определенными гормон-узнающими элементами ДНК (hormone response element).
(R) тиреоидных гормонов находятся в ядре в связанном с хроматином состоянии (за исключением рецепторов эстрогенов, которые в ядре образуют комплексы с hsp). После взаимодействия с гормоном изменяется конформация (R), что повышает его сродство к ДНК, т. е. (R) может связываться со специфическими генами в ядре, регулируя их экспрессию.
ГОРМОНЫ — ПРОИЗВОДНЫЕ БЕЛКОВ, ПЕПТИДОВ
И АМИНОКИСЛОТ
ГОРМОНЫ ГИПОТАЛАМУСА
Нейроны гипоталамуса синтезируют гормоны и секретируют их в капиллярную сеть, доставляющую гормоны к клеткам гипофиза. Эти гормоны являются пептидами. Они делятся на: 1) гормоны, усиливающие (высвобождающие, либерины) секрецию и выделение соответствующих тропных гормонов передней доли гипофиза, и 2) угнетающие (ингибирующие, статины) эти процессы.
| Гормоны | Эффект | |
| Кортиколиберин | Стимулирует образование кортикотропина и липотропина | |
| Гонадолиберин | Стимулирует образование лютропина и фоллитропина | |
| Пролактолиберин | Способствует выделению пролактина | |
| Пролактостатин | Ингибирует выделение пролактина | |
| Соматолиберин | Стимулирует секрецию гормона роста | |
| Соматостатин | Ингибирует секрецию гормона роста и тиреотропина | |
| Тиролиберин | Стимулирует секрецию тиреотропина и пролактина | |
| Меланолиберин | Стимулирует секрецию меланоцит-стимулирующего гормона | |
| Меланостатин | Ингибирует секрецию меланоцит-стимулирующего гормона | |
Либерины действуют на клетки гипофиза, мембраны которых имеют 7-ТМС-(R). После связывания 7-ТМС-(R) с гормоном активируется аденилатциклазный каскад передачи сигнала в клетку. Таким образом, либерины стимулируют синтез и высвобождение тропных гормонов гипофиза посредством цАМФ (может включаться также ИТФ-механизм).
ГОРМОНЫ АДЕНОГИПОФИЗА
Это гормоны белково-пептидной природы.
| Гормоны | Эффект |
| СТГ (соматотропин, гормон роста) | Стимулирует рост организма, синтез белка в клетках, образование глюкозы и распад липидов |
| Пролактин | Регулирует лактацию у млекопитающих, инстинкт выхаживания потомства, дифференцировку различных тканей |
| ТТГ (тиреотропин) | Регулирует биосинтез и секрецию гормонов щитовидной железы |
| Кортикотропин | Регулирует секрецию гормонов коры надпочечников |
| ФСГ (фоллитропин) и ЛГ (лютеинизирующий гормон) | ЛГ регулирует синтез женских и мужских половых гормонов, стимулирует рост и созревание фолликулов, овуляцию, образование и функционирование желтого тела в яичниках
ФСГ оказывает сенсибилизирующее действие на фолликулы и клетки Лейдига к действию ЛГ, стимулирует сперматогенез |
Гормон роста (СТГ). Многие эффекты СТГ опосредуются соматомединами — тканевыми факторами, секретируемыми под влиянием гормона роста. Соматомедины-факторы сульфатирования усиливают использование сульфата и синтез коллагена хрящевой тканью; соматомедины-факторы роста (особенно схожие по строению с инсулин-рецепторными субстратами IRS-1 и IRS-2) активируют рост клеток и тканей.
Связываясь с IRS, гормон роста оказывает разнообразное влияние на метаболизм. Основное действие СТГ — обеспечить рост и развитие организма. Под влиянием гормона усиливается синтез белков и нуклеиновых кислот в костях, хрящах, мышцах, печени и других внутренних органах; ускоряется транспорт аминокислот внутрь клеток. Одновременно тормозится катаболизм белков, что проявляется снижением уровня остаточного азота и мочевины в крови, положительным азотистым балансом.
СТГ стимулирует липолиз. Образующаяся при этом энергия используется на процессы анаболизма. СТГ участвует в регуляции уровня глюкозы в крови — это «контринсулярный» гормон (он снижает использование глюкозы жировыми и мышечными клетками и активирует глюконеогенез в печени). Секреция СТГ увеличивается при преимущественно белковом питании и голодании, физических упражнениях, стрессе, сразу же после засыпания.
Избыточная секреция СТГ у детей и подростков приводит к развитию гигантизма (рост костей пропорционален). У взрослых избыток СТГ проявляется акромегалией (диспропорциональным ростом костей скелета, мягких тканей, внутренних органов).
Тиреотропин — основной регулятор функции щитовидной железы. Синтезируется базофильными клетками передней доли гипофиза.
Гонадотропины, как и тиреотропин, являются гликогликопротеинами. К гонадотропинам относятся фолликулостимулирующий гормон (ФСГ, фоллитропин), лютеинизирующий гормоном (ЛГ, лютропин), а также хорионический гонадотропин. Мембраны гонадотрофов содержат 7-ТМС-(R), взаимодействующие с гонадолиберином гипоталамуса. Последний стимулирует высвобождение гонадотропинов гипофиза.
Гонадотропины у мужчин и женщин выполняют разные функции. ФСГ у женщин обеспечивает созревание фолликулов яичников, которые начинают активно синтезировать эстрадиол. Повышение секреции эстрадиола оказывает тормозящее действие на образование и секрецию ФСГ передней долей гипофиза (механизм обратной связи). После овуляции разрушенный фолликул развивается в желтое тело, продолжительность функции которого зависит от стимулирующего эффекта ЛГ. Падение уровня ЛГ приводит к снижению стероидогенеза, что становится причиной наступления менструации. В семенниках ФСГ и ЛГ активируют сперматогенез и увеличивают образование тестостерона.
АКТГ (кортикотропин) — это пептид (39 аминокислот). АКТГ регулирует стероидогенез и поддерживает оптимальную массу надпочечников. (R) кортикотропина относятся к 7-ТМС-(R), включающим механизм синтеза цАМФ. цАМФ, активируя протеинкиназу А, влияет на ключевую реакцию синтеза стероидных гормонов из холестерола. Влияние на поддержание массы надпочечников также опосредуется 7-ТМС-рецеторным действием АКТГ, что в итоге приводит к активации протеинкиназ. Протеинкиназы участвуют в биосинтезе нуклеиновых кислот и активируют стероидогенез.
АКТГ усиливает липолиз, стимулирует поглощение аминокислот и глюкозы мышечной тканью, вызывает гипогликемию вследствие ускорения высвобождения инсулина из поджелудочной железы. АКТГ усиливает пигментацию кожи, поэтому при заболеваниях, сопровождающихся высоким содержанием АКТГ в плазме (болезнь Аддисона), наблюдается избыточная пигментация.
Секреция АКТГ изменяется в течение суток и регулируется по принципу обратной связи. Она усиливается при действии стрессовых факторов.
Меланоцит-стимулирующие гормоны синтезируются клетками промежуточной доли гипофиза млекопитающих. У человека эта доля редуцирована, но единичные клетки, характерные для средней доли, локализуются в дистальной части гипофиза.
Липотропины. На С-конце молекулы β-липотропина расположены пептидные фрагменты, обладающие особой биологической активностью. Это — эндогенные опиоиды (экефалины и эндорфины). Они обладают обезболивающим действием, спазмолитической активностью, участвуют в половом поведении, питании, обучении, памяти.
ГОРМОНЫ ЗАДНЕЙ ДОЛИ ГИПОФИЗА
Окситоцин и вазопрессин принято считать гормонами задней доли гипофиза, хотя они образуются и секретируются нейронами гипоталамуса. Эти нанопептиды схожи по строению. Свое название вазопрессин получил из-за способности повышать артериальное давление, а название «окситоцин» связано со способностью гормона ускорять роды.
Вазопрессин, помимо сосудосуживающего действия, обеспечивает сохранение воды в организме, стимулируя её реабсорбцию в почечных канальцах. Регулятором секреции гормона является изменение осмотического давления и объёма циркулирующей крови.
Окситоцин усиливает сокращение мышц матки во время родов, стимулирует лактацию, регулирует поведенческую активность, связанную с беременностью, лактацией и уходом за потомством. Обнаружено участие окситоцина в механизмах памяти. Главными стимулами высвобождения окситоцина являются эстрогены и нервные импульсы, возникающие при раздражении грудных сосков. Прогестерон ингибирует продукцию окситоцина. У мужчин окситоцин стимулирует семявыносящие протоки (эякуляцию), влияет на поведенческую активность, связанную с половой функцией.
Недостаточность вазопрессина проявляется в форме несахарного диабета, главными симптомами которого являются жажда и полиурия, но, в отличие от сахарного диабета, моча при недостаточности вазопрессина не имеет сладкого вкуса, а её удельный вес низкий.
ГОРМОНЫ ЩИТОВИДНОЙ ЖЕЛЕЗЫ
Тиреоидные гормоны оказывают влияние на фундаментальные физиологические процессы: клеточную дифференцировку, рост и метаболизм тканей.
В фолликулах щитовидной железы (ЩЖ) образуются 2 основных гормона: Т3 и Т4, которые действуют на клетки через внутриклеточные ядерные (R).
Особенностью гормонов ЩЖ является присутствие в их молекуле йода. В основе их структуры лежит тирониновое ядро, состоящее из двух конденсированных молекул L-тирозина. В ядро могут включаться 3 или 4 атома йода: 3,5,3’,5′-тетрайодтиронин (Т4, тироксин) и 3,5,3′-трийодтиронин (Т3). Третье производное тиронина — 3,3′,5-T3 — не обладает гормональной активностью. Это «обратный Т3». Несмотря на то что Т3 намного активнее, чем Т4, в ЩЖ синтезируется главным образом Т4. Трийодтиронин образуется из Т4 путём дейодирования последнего в периферических тканях. Т3 обладает на порядок более высоким сродством к (R) периферических тканей, чем Т4.
Синтез гормонов ЩЖ осуществляется в 4 этапа. Во-первых, включение йода в ЩЖ с помощью йодного насоса, в работе которого принимает участие Na+-K+-зависимая АТФ-аза. Во-вторых, синтез тиреоидных гормонов, который начинается с включения йода в молекулы тирозинов, входящих в состав тиреоглобулина. Тиреоглобулин — главный белок коллоида, заполняющего фолликулы. Процесс йодирования тирозинов осуществляется с помощью тиреопероксидазы и H2О2 и стимулируется ТТГ. В-третьих, конденсация моно- и дийодтиронинов с образованием Т3 из Т4 под влиянием тиреопероксидазы. По мере йодирования остатков тирозина молекулы тиреоглобулина перемещаются в просвет фолликула, где они накапливаются «про запас». В-четвертых, секреция гормонов, которые освобождаются из тиреоглобулина при участии гидролаз лизосом эпителиальных клеток.
Регуляция синтеза гормонов ЩЖ осуществляется гипоталамо-гипофизарной системой по принципу обратной связи: повышение уровня Т3 ингибирует высвобождение и синтез тиреотропина в гипофизе и тиреолиберина в гипоталамусе.
Влияние на метаболизм. Гормоны ЩЖ необходимы для нормального роста и развития организма. Они контролируют образование тепла, скорость поглощения кислорода, участвуют в поддержании нормальной функции дыхательного центра, оказывают инотропный и хронотропный эффекты на сердце, увеличивают количество β-адренергических рецепторов в сердечной и скелетной мыщцах, жировой ткани и лимфоцитах, увеличивают образование эритропоэтина и повышают эритропоэз, стимулируют моторику желудочно-кишечного тракта, стимулируют синтез многих структурных белков в организме. Суммарный эффект T4 и T3 оценивается по изменению скорости потребления O2 тканями, отражающей интенсивность метаболических процессов в них. Повышение потребления О2 под действием тиреоидных гормонов связано с усилением окисления жирных кислот. Гормоны ЩЖ увеличивают активность мембраносвязанной Na+-K+-ATФазы клеток, влияя тем самым на механизмы активного транспорта веществ. Давно известен разобщающий эффект T4 на процесс тканевого дыхания в митохондриях.
Зоб. Увеличение ЩЖ — это «попытка» организма компенсировать сниженное образование тиреоидных гормонов. Гипотиреоз — это состояние, развивающееся при нарушении синтеза или транспорта гормонов ЩЖ (особенно характерно снижение основного обмена). Гипотиреоз у плода и новорожденного приводит к нарушению роста, тяжелой необратимой задержке умственного развития (кретинизму). Гипотиреоз у детей старшего возраста проявляется отставанием в росте без задержки умственного развития. Гипертиреоз (тиреотоксикоз) возникает при гиперпродукции гормонов ЩЖ. Наиболее известная патология — базедова болезнь.
ГОРМОНЫ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
Инсулин (I) — анаболический гормон, способствующий сохранению глюкозы, жирных кислот и аминокислот. Глюкагон, наоборот, — катаболический: он мобилизует глюкозу, жирные кислоты и аминокислоты из тканевых запасов в кровоток. Эти два гормона функционально взаимосвязаны.
I — полипептид, состоящий из двух цепей: А-цепь содержит 21 аминокислоту, B-цепь — 30. Обе цепи связаны двумя S-S-мостиками. I человека отличается от инсулина свиньи только одной аминокислотой. Синтез I проходит по законам синтеза секретируемых белков.
Эффекты I многообразны, имеют временную зависимость: 1) быстрый (секунды) — ускорение транспорта глюкозы, аминокислот и калия в инсулинзависимые ткани; 2) промежуточный (минуты) — стимуляция синтеза белков и торможение их распада, активирование ферментов гликолиза и гликогенсинтазы, угнетение ферментов глюконеогенеза и фосфорилазы; 3) длительный (часы) — увеличение синтеза иРНК, ферментов липогенеза и др. Результирующий эффект влияния I — накопление углеводов, белков и жиров. Эффекты I тканеспецифичны.
Комплекс нарушений, вызванных недостаточностью функций I, называется сахарным диабетом. Диабет характеризуется полиурией, полидипсией, потерей веса (при увеличенном аппетите), гипергликемией, глюкозурией, кетозом, ацидозом, которые нередко заканчиваются комой. Избыток внеклеточной глюкозы сопровождается её внутриклеточным дефицитом — «голодание среди изобилия», уменьшением поступления аминокислот в мышцы и увеличением скорости липолиза. Характерный признак диабета — гипергликемия, которая заметно проявляется после еды, поэтому после глюкозной нагрузки концентрация глюкозы в плазме у больного диабетом значительно выше, чем у здорового, а возвращение к начальному уровню проходит медленнее. Гипергликемия >10 ммоль/л превышает реабсорбционные возможности почек и становится причиной глюкозурии. Выделение oсмотически активных молекул глюкозы влечет за собой потерю больших количеств воды (осмотический диурез). Длительная гипергликемия способствует неферментативному гликозилированию белков. Определение уровня гликозилированной формы гемоглобина HbA1С используется для оценки эффективности лечения инсулином. Основные нарушения обмена липидов при диабете: усиление катаболизма липидов, увеличение образования кетоновых тел, снижение синтеза жирных кислот и триацилглицеролов. В силу недостаточости I нарушается гликолиз и стимулируется образование глюкозы из белков (глюконеогенез). Потребности в энергии удовлетворяются катаболизмом белков и жиров. Развивается белковая недостаточность. Больной теряет вес. В кровотоке накапливаются кетоновые тела, так как скорость их образования превышает возможности клеток по их использованию. Это приводит к развитию метаболического ацидоза. К дегидратации добавляются потери Na+ и K+.
Выделяют две формы диабета:
1) I-зависимый сахарный диабет (диабет 1-го типа), развивается вследствие дефицита I, вызываемого аутоиммунным разрушением β-клеток pancreas;
2) I-независимый сахарный диабет (диабет 2-го типа), характеризуется устойчивостью к I и сниженной секрецией I. Он встречается чаще, развивается у пожилых лиц.
Глюкагон — пептид (29 аминокислот), синтезируемый α-клетками pancreas. Он действует через 7-TMС-(R). Гормон усиливает распад гликогена за счёт активации гликоген-фосфорилазы (с участием цАМФ) и фосфолипазы C (увеличивая уровень цитоплазматического Ca2+). Гликогенолиз стимулируется в печени, но не в мышцах. Глюкагон — мощный стимулятор липолиза. Повышая содержание цАМР в адипоцитах, он активирует гормон-чувствительную липазу. Образующиеся при этом в большом количестве жирные кислоты могут использоваться в качестве источников энергии или превращаться в кетоновые тела. Глюкагон стимулирует глюконеогенез.
Основной регулятор секреции глюкагона — глюкоза: увеличение в ответ на гипогликемию и снижение при повышении уровня глюкозы в крови; секреция гормона возрастает также при потреблении белков.
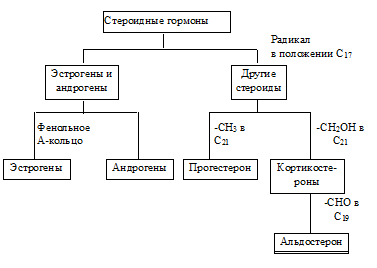
СТЕРОИДНЫЕ ГОРМОНЫ
Структурные особенности различных стероидных гормонов можно иллюстрировать следующей схемой:
Синтез гормонов коры надпочечников.
В гломерулярной зоне синтезируются минералокортикоиды, в пучковой (средней) — глюкокортикоиды, в ретикулярной сосредоточены ферменты для синтеза андрогенов. Общими в синтезе всех стероидных гормонов являются первые две реакции:
1. Превращение холестерола в прегненолон в результате отщепления 6С- фрагмента от боковой цепи (фермент С20-22 десмолаза). Десмолаза — ключевой фермент в биосинтезе стероидов. Его фосфорилирование (активацию) стимулирует АКТГ.
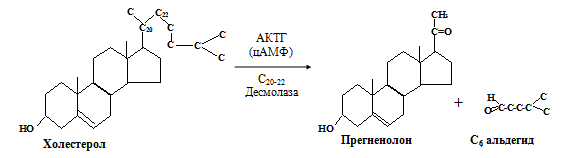
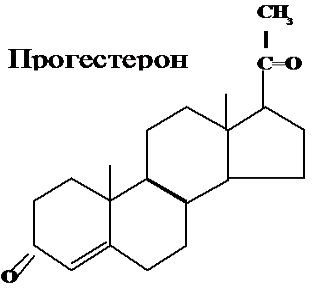
2. Окисление и изомеризация прегненолона в прогестерон. Прегненолон является предшественником всех стероидных гормонов.
В желтом теле (в яичниках) синтез стероидов останавливается на этапе образования прогестерона. Во всех других стероидпродуцирующих тканях прогестерон является только промежуточным продуктом синтеза других стероидов.
Превращения прогестерона. Сначала прогестерон подвергается гидроксилированию в положениях С-17 или С-21, в результате чего образуются различные функциональные классы стероидов.
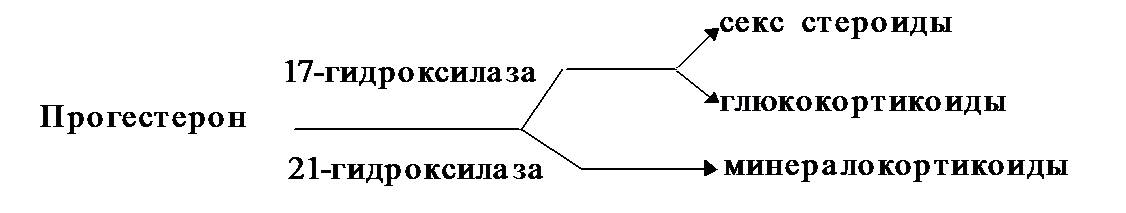
Гидроксилирование прогестерона в положении С-21 или С-11 приводит к образованию минералокортикоидов, в С-17 — глюкокортикоидов.
Функция минералокортикоидов (альдостерона) заключается в реабсорбции Na+ в дистальных канальцах почек (о механизмах рецепции стероидных гормонов см. выше).
Глюкокортикоиды (кортизол и гидрокортизон) оказывают катаболическое влияние на скелетные мышцы и анаболическое — на печень, где они стимулируют синтез ферментов глюконеогенеза, в результате чего уровень глюкозы в крови повышается. Кроме того, глюкокортикоиды регулируют реакции иммунитета и в терапевтических дозировках оказывают выраженное противовоспалительное действие.
Регуляция синтеза кортикостероидов: как указывалось, ключевой фермент синтеза стероидов — С20–22 десмолаза. Важнейшим регулятором синтеза альдостерона является ангиотензин II — пептид, образующийся из белка плазмы в результате отщепления от него двух олигопептидов: вначале под действием ренина образуется ангиотензин I, затем под действием ангиотензинпревращающего фермента из ангиотензина I образуется ангиотензин II. Ангиотензин II связывается с поверхностью клеток клубочковой зоны коры надпочечников и стимулирует фосфорилирование С20–22 десмолазы.
На секрецию кортизола влияют АКТГ, физический и эмоциональные стрессы, состояние тревоги, страха, волнения и боль. Эти реакции могут нивелировать воздействия системы отрицательной обратной связи и суточного ритма. Свободные глюкокортикоиды ингибируют секрецию АКТГ.
Глюкокортикоиды в высоких концентрациях нашли широкое применение для лечения аутоиммунных заболеваний или для подавления реакции отторжения при пересадке тканей. Высокие дозы глюкокортикоидов подавляют воспалительную реакцию.
Недостаточность ферментов, катализирующих синтез кортикостероидов, ведет к гиперплазии надпочечников. При избытке глюкокортикоидов развивается синдром Кушинга. Основные проявления этого синдрома вызваны усилением распада белков. Отмечается своеобразное отложение жира: ожирение туловища и «лунообразное» лицо, в то время как подкожножировая клетчатка конечостей атрофируется. Недостаточность надпочечников проявляется Аддисоновой болезнью (внешнее проявление — гиперпигментация кожи).
ПОЛОВЫЕ ГОРМОНЫ
Изменения секреции половых гормонов оказывают существенное влияние на интенсивность метаболических процессов и лежат в основе развития организма и механизмов старения. Половые гормоны действует через внутриклеточные рецепторы
Синтез андрогенов в яичках. Вначале из прегненолона (или прогестерона) при участии 17-гидроксилазы образуется С17-ОН производное — 17-ОН прегненолон (17-ОН прогестерон).
Затем от Д-кольца отщепляется боковая цепь с помощью С17–20 лиазы. При этом образуются мужские половые гормоны дигидроэпиандростерон, андостендион и тестостерон, которые могут взаимопревращаться друг в друга под действием изомеразы. Важнейшим мужским половым гормоном является тестостерон. Однако в большинстве периферических тканей основным активным андрогеном является дигидротестостерон, рецепторы для которого обнаружены в простате, семенных пузырьках, коже гениталий и наружных половых органах. Фермент, катализирующий превращение тестостерона в дигидротестостерон, называется 5--редуктазой.
Синтез мужских половых гормонов стимулирует лютеинизирующий гормон гипофиза, синтез и секреция которого, в свою очередь, регулируется гонадолиберином.

Мужские половые гормоны влияют на дифференцировку тканей, развитие вторичных половых структур, участвуют в процессах сперматогенеза. Они оказывают выраженное анаболическое действие, усиливая процессы синтеза белков, что выражается в увеличении мышечной массы, росте костей; способствуют задержке натрия, калия, воды, кальция, сульфата и фосфата.
Синтез эстрогенов в клетках яичников. Субстратами для синтеза эстрогенов являются андрогены. Синтез эстрогенов регулируют лютеинизирующий гормон и гонадолиберин.

К эстрогенам относятся также эстрон и эстрадиол. Эстрогены регулируют синтез белков. Подобно другим стероидам эстрогены, проникая в клетку, взаимодействуют с внутриклеточным рецептором. Комплекс гормон – рецептор затем связывается со специфической нуклеотидной последовательностью на ДНК и регулирует синтез иРНК.
Транспорт стероидных гормонов осуществляется с помощью белков-переносчиков, синтезируемых в печени. Это — транскортин (белок, связывающий кортикостероиды) и секс-стероид-связывающий белок. Неспецифический транспорт осуществляется альбуминами.
Катаболизм стероидных гормонов. В клетках организма отсутствуют ферменты, которые раскрывали бы стероидную циклическую структуру, но имеются механизмы, посредством которых циклическая структура приобретает растворимость в водной среде и за счет этого становится возможным её экскреция из организма. Этими механизмами являются: 1) восстановление двойных связей в составе циклической структуры; 2) реакции конъюгации с УДФ-глюкуроновой кислотой или ФАФС (глюкуроновая кислота или активный сульфат связываются с ОН-группой в составе стероидной циклической структуры) — эти конъюгаты растворимы.
ГОРМОНЫ ПОЛОВЫХ ЖЕЛЁЗ
ЖЕНСКИЕ ПОЛОВЫЕ ГОРМОНЫ
Женские половые гормоны представлены эстрогенами и
прогестинами (гестагенами).
К эстрогенам относятся: эстрадиол (рис. 12; образуется в
фолликулах яичников), эстриол (гормон плаценты) и эстрон
(синтезируется в коре надпочечников). Представителем прогестинов
является прогестерон, который вырабатывается в желтом теле
яичников. Небольшое количество женских половых гормонов
вырабатывается в организме мужчин.
Ткани, чувствительные к действию эстрогенов, делятся на2
группы: половые органы и неполовые органы.
Действие женских половых гормонов на половые органы
В половых органах женские половые гормоны способствуют
развитию и функционированию этих органов и формированию
вторичных половых признаков в период полового созревания.
В матке увеличивается рост железистого эпителия эндометрия
и гладкой мускулатуры миометрия, усиливается васкуляризация
органа.
Во влагалище увеличивается число слоев клеток, что является
диагностическим критерием действия эстрогенов на организм.
В молочной железе эстрогены стимулируют рост протоков,
прогестерон– рост железистой ткани.
Действие женских половых гормонов на неполовые органы
В неполовых органах эстрогены оказывают также характерное
действие.
ЦНС, гипоталамус, гипофиз — под влиянием гормонов
происходит формирование типичного полового поведения,
инстинкта, психики женщины.
Кости, хрящи, гортань- эстрогены способствуют
формированию характерного«женского» типа скелета, гортани и
голоса. Эстрогены ускоряют окостенение эпифизов, где находятся
зоны роста кости, поэтому, если у девочки в период полового
созревания образуется мало эстрогенов, замедляется окостенение
эпифизов, и в этом случае девочка может иметь необычно высокий
рост. У взрослых женщин при продолжительном введении эстрогенов
или их избыточном образовании в организме происходит
интенсивное обызвествление костей, и могут исчезать полости, в
которых находится костный мозг, что приводит к развитию анемии.
Кожа– эстрогены способствуют росту волос по женскому типу,
тормозят рост волос на коже, снижают секреторную активность
сальных желез (понижают сальность кожи).
Печень– эстрогены стимулируют синтез специфических белков
печени: ангиотензиногена, способствующего повышению
артериального давления, и некоторых факторов свертывания крови
(II, VII, IX, X). Поэтому при избытке эстрогенов в организме
наблюдается склонность к гипертонии и тромбозам.
Кроме этого, эстрогены, воздействуя на печень, увеличивают
образование в ней липопротеинов очень низкой плотности (ЛПОНП)
и липопротеинов высокой плотности (ЛПВП). ЛПОНП на50 %
состоят из триглицеридов (нейтрального жира), из печени они через
кровь доставляются в жировую ткань, где жир откладывается.
Поэтому у женщин мышцы всегда покрыты слоем подкожного жира.
ЛПВП уменьшают концентрацию холестерина в крови, способствуют
его выведению из организма. Поэтому женщины реже, чем мужчины,
заболевают атеросклерозом и инфарктом миокарда.
Жировая ткань– в ней эстрогены и прогестерон увеличивают
синтез жира, тормозят его расщепление, способствуют
формированию типично женских жировых отложений.
Почки– эстрогены способствуют задержке натрия в организме,
прогестерон усиливает потерю натрия с мочой. Поскольку при
беременности образуется много прогестерона, натрий усиленно
теряется организмом, отсюда– тяга к соленой пище.
МУЖСКИЕ ПОЛОВЫЕ ГОРМОНЫ
Мужские половые гормоны (андрогены) представлены
тестостероном (рис. 13) и андростероном. Они образуются в
семенниках, коре надпочечников, предстательной железе. Небольшое
количество андрогенов синтезируется у женщин в яичниках.
Действие мужских половых гормонов на половые органы
В половых органах мужские половые гормоны оказывают
андрогенное действие, то есть способствуют развитию и
функционированию этих органов и формированию вторичных
половых признаков в период полового созревания.
Действие мужских половых гормонов на неполовые органы
В неполовых органах андрогены обладают генерализованным
анаболическим действием, то есть стимулируют синтез
нуклеиновых кислот, белка, задерживают в организме азот и кальций,
усиливают синтез фосфолипидов мембран.
ЦНС, гипоталамус, гипофиз– под влиянием андрогенов
происходит формирование типичного полового поведения, инстинкта
и психики мужчины, то есть образуются поведенческие особенности
мужского пола. Андрогены влияют на развитие мозга. Если во
внутриутробном периоде в критические стадии развития и
дифференцировки мозга развивается недостаточность андрогенов, то
в будущем у этого юноши или мужчины могут возникнуть варианты
половой ориентации. Избыток андрогенов в организме способствует
агрессивности.
Кости, хрящи, гортань– андрогены способствуют
формированию характерных физиологических особенностей
мужского скелета, гортани, голоса, усиливают отложение фосфорно-кальциевых солей в эпифизарных зонах роста. Чрезмерная выработка
гормонов может приводить к преждевременному заращению
эпифизов и развитию низкорослости.
Мышцы– андрогены увеличивают мышечную массу и силу,
создают характерную рельефность мышц.
Кожа– андрогены обладают стимулирующим действием на
сальные железы, повышая сальность кожи, усиливают пигментацию
кожи (солнечный загар), увеличивают рост волос на лице и теле,
способствуют росту волос по мужскому типу. Избыток гормонов
может привести к облысению.
Жировая ткань– андрогены ускоряют расщепление жира в
жировой ткани, тормозят его синтез.
В печени и почках андрогены резко увеличивают синтез белка, в
кроветворных органах усиливают эритропоэз.
Анаболические стероиды
На основе мужских половых гормонов синтезированы аналоги
этих соединений– анаболические стероиды, обладающие
максимальной анаболической активностью и минимальной–
андрогенной. Первоначально анаболические стероиды широко
применяли для откорма скота. Однако анаболические стероиды очень
плохо метаболизируют в организме животных и не разрушаются при
термической обработке пищи. Поэтому, попадая с мясом в организм
человека, анаболические стероиды вызывали тяжелые поражения
печени, в том числе опухоли, поскольку продукты превращения этих
соединений являются канцерогенами.
В настоящее время применение анаболических стероидов в
практике животноводства уменьшилось. Однако некоторые
спортсмены продолжают применять этих средства для повышения
спортивных результатов. Тем не менее, установлено, что даже
относительно кратковременное (в течение2 лет) применение
анаболиков в возрастном периоде с18 до26 лет (кроме
перечисленных опасностей для здоровья спортсмена) может привести
у мужчин к ранней импотенции, а у женщин– к раку молочной
железы.
Небольшие дозы анаболических стероидов применяют в
лечебной практике у лиц после35 лет при тяжелых травмах,
инфаркте миокарда, после операций для ускорения заживления ран,
увеличения массы тела и улучшения аппетита при истощении.
