ГЕННАЯ ИНЖЕНЕРИЯ РАСТЕНИЙ
5.1 Проблемы биобезопасности
5.2. Получение трансгенных растений
5.3. Применение методов генетической инженерии для улучшения аминокислотного состава запасных белков растений
5.4. Повышение эффективности процесса фотосинтеза
5.5. Генно-инженерные подходы к решению проблемы усвоения азота
5.6. Изменение качества плодов
5.7. Устойчивость растений к гербицидам
5.8. Устойчивость растений к фитопатогенам и насекомым
5.9. Устойчивость растений к абиотическим стрессам
Генно-инженерные методы, в частности технология рекомбинантных ДНК, позволяют создавать новые генотипы и, следовательно, новые формы растений гораздо быстрее, чем классические методы селекции. Кроме того, появляется возможность целенаправленного изменения генотипа — трансформации — благодаря введению определенных генов.
Считается, что трансгенные растения более безопасны, чем сорта, полученные методами традиционной селекции, но с применением мутагенеза (В. Ф. Федоренко и др., 2005). Есть мнение, что риск использования трансгенных растений в мирных биотехнологиях намного ниже, чем в случае применения других трансгенных организмов (Я. И. Бурьянов, 1999). Генетическая инженерия растений развивается очень быстрыми темпами. Она позволяет решать проблемы фундаментальной науки, а также многочисленные практические задачи. Намечается тенденция разделения прикладных генно-инженерных исследований на три направления:
- Решение проблем сельскохозяйственного комплекса, таких, как повышение продуктивности сельскохозяйственных растений, их защита от различных биотических и абиотических факторов. Это особенно важно в связи с быстрым ростом населения Земли. Считается, что генетически модифицированные (ГМ) растения помогут решить проблему увеличения производства продуктов питания, поэтому сейчас наблюдается весьма значительное расширение сельскохозяйственных угодий, занятых посевами ГМ — растений. Если в 1996 г. эти посевы занимали 1,7 млн га, то в 2001 г. — 52,6 млн га, а в 2003 г. — почти 70 млн га.
- Создание трансгенных растений — продуцентов новых веществ для использования в области медицины и технической промышленности, приспособленных для роста в полевых условиях. Так, на основе трансгенных растений возможно получение «съедобных» вакцин, антител (например, иммуноглобулиновых комплексов).
Развитие и совершенствование культуры трансгенных клеток и тканей растений, синтезирующих ценные биологически активные соединения. Довольно часто продуцентами важных пищевых, лекарственных или технически важных веществ служат уникальные тропические и эндемические растения, не доступные для выращивания в других климатических зонах или занесенные в «Красную книгу». Перенос генов, отвечающих за синтез специфических соединений, из редких растений в более доступные превращает последние в биологические фабрики необходимых веществ.
Генетическая трансформация может принести большую пользу для сельского хозяйства, медицины, промышленности, фундаментальной науки.
Однако биотехнология и, в частности, генетическая инженерия подошли к той ступени развития, когда приходится прежде всего думать о возможных последствиях эксперимента, об использовании полученных знаний. «Генетическая инженерия — это мощный способ изменить жизнь, но ее потенциал может представлять собой опасность» (Р. Доукинс, цит.: Современная биотехнология. Мифы и реальность, 2004). В связи с этим первостепенными становятся вопросы биологической безопасности.
Под биологической безопасностью понимается защищенность человека, общества, цивилизации и окружающей среды от вредного воздействия, опасного для жизни и здоровья людей, от токсичных и аллергенных биологических веществ и соединений, содержащихся в природных или генетически модифицированных биологических объектах и полученных из них продуктах (О. С. Машкина, А. К. Буторина, 2005). В настоящее время выделяют три группы риска, возникающие при возделывании и потреблении генетически модифицированных организмов (ГМО): пищевые, экологические, агротехнические. Причины возникновения этих рисков состоят в непредсказуемости встраивания дополнительной ДНК в геном организма, возможности плейотропного эффекта встроенного гена, нарушении стабильности генома трансгенных растений, присутствии во встраиваемой конструкции «лишних» векторных генов, аллергических и токсических эффектах чужеродного белка, возможности горизонтального переноса трансгенных конструкций в геном симбионтных для человека и животных бактерий (В. В. Кузнецов и др., 2004). По-видимому, есть закономерность между увеличением числа аллергических заболеваний и потреблением ГМ-про- дуктов в странах, где это потребление разрешено. Так, в США и Скандинавии был проведен сравнительный анализ количества пищевых заболеваний. Эти страны были выбраны в связи с тем, что единственным существенным различием в качестве питания были потребление генетически модифицированных продуктов в США и их отсутствие в рационе народов Скандинавии. Оказалось, что в США частота пищевых заболеваний в 3 — 5 раз выше
чем в странах Скандинавии (В. В. Кузнецов и др., 2004). Нельзя исключить, что генетическая инженерия может привести к результатам, опасным для человека и природы. Поэтому несомненно, что биологическая безопасность должна стать одной из приоритетных задач человечества в целом и каждой цивилизованной страны в отдельности (А.С.Спирин, 1997, цит.: В.В.Кузнецов и др., 2004).
5.2. Получение трансгенных растений
Технологии получения трансгенных растений практически совпадают с теми технологиями, которые обсуждались в учебном пособии, когда речь шла о передаче генетической информации у микроорганизмов и животных. Поэтому в данном разделе рассмотрим только те системы, которые специфичны для растительных организмов.
Векторы на основе Ti-плазмид. Перенос генов и их встраивание в геном двудольных растений (трансформация) осуществляются главным образом благодаря конструированию векторов, характерных для растений. Эти векторы создаются на основе Ti-плазмид, находящихся в клетках бактерий Agrobacterium faciens.
Среди многочисленных почвенных бактерий существуют бактерии рода Agrobacteria, которые могут передавать часть своих генов в геном растительной клетки, вызывая коренные изменения в ее свойствах. Так, бактерия A. tumefaciens вызывает образование опухолей — корончатых галлов. Способность этой бактерии к образованию опухоли связана с геномом большой внехромосомной плазмиды —Ti-плазмиды (от англ. tumor inducing — индуцирующие опухоль). Другие бактерии ( . rhizogenes) вызывают усиленное образование корней при заражении растений. За этот процесс ответственны содержащиеся в бактериальных клетках Ri- плазмиды (от англ. root inducing — индуцирующий корни). Ti- и Ri-плазмиды — естественные векторы для дополнительных генов, обладающие свойствами, которые необходимы для трансформации растительных клеток. Они имеют широкий круг хозяев, а в бактериальных клетках реплицируются автономно. Ri-плазмиды выгодно отличаются от Ti-плазмид тем, что они не онкогенны. Клетки растений, трансформированные с помощью Ri-плазмид, сохраняют способность к морфогенезу и регенерации растений. В связи с этим Ri-плазмиды в данный момент рассматриваются как более перспективные для создания векторов. Однако Ti-плазмиды изучены лучше, поэтому их, как правило, используют при работе с растениями.
Доказательством того, что именно Ti-плазмиды отвечают за трансформацию растительных клеток в опухолевые, служит тот факт, что клетки агробактерий, лишенные Ti-плазмид, не могут вызвать в инфицированном растении ни образования корончатых галлов, ни синтеза опинов. Опины — это уникальные продукты конденсации амино- и кетокислот или аминокислот и сахаров, которые используются бактериями в качестве источников азота, углерода и энергии.
После заражения часть Ti-плазмиды встречается в хромосомах клеток растения-хозяина. Следовательно, A. tumefaciens встраивает часть своего генома в ДНК растительной клетки и заставляет ее таким способом изменять метаболизм, синтезируя вещества, необходимые для бактерий. Сама бактерия в растительную клетку не проникает. Она остается в межклеточном пространстве, используя трансформированные клетки растений в качестве биологической «фабрики» по производству опинов.
Участок Ti-плазмиды, который встраивается в геном растительных клеток, называется Т-ДНК — трансформирующая ДНК (transferred DNA). Величина Т-ДНК составляет примерно 10% от размера всей Ti-плазмиды, т.е. 12—22 тыс. п.н. Т-ДНК содержит гены, отвечающие за индукцию образования опухоли, синтез опинов и фитогормонов (ауксинов и цитокининов), подавляющих дифференцировку клеток растения-хозяина. Гены, отвечающие за вырезание Т-ДНК и ее перенос в растительную клетку, расположены в области вирулентности (vir-область) той же самой плазмиды. Кроме того, в состав Ti-плазмиды входят гены tra-области, контролирующие конъюгацию бактерий, и гены ori-области, продукты которых обеспечивают репликацию Ti-плазмиды (рис. 5.17).
Молекулярно-генетический механизм естественной трансформации растительных клеток с помощью Ti-плазмид изучен достаточно хорошо. В этом процессе можно выделить несколько этапов:
- восприятие раневых си гнал ор растительной клетки хеморецепторами бактерии и прикрепление агробактерии к стенке клетки растения;
- вырезание Т-ДНК из Ti-плазмиды;
- проникновение Т-ДНК внутрь клетки растения;
- интеграция Т-ДНК в геном растения и ее экспрессия.
Трансформация начинается только там, где есть поврежденные клетки. Весь процесс «узнавания» нужной растительной клетки, вырезания, транспорта и встраивания Т-ДНК в растительный геном осуществляют белки — продукты генов, локализованных в vir-области Ti-плазмиды. Продукты гидролиза поврежденной клеточной стенки (ацетосирингон и гидроксиацетосирингон) воспринимают хеморецепторы, встроенные в плазматическую мембрану агробактерии.

Среди них одна из главных ролей принадлежит продукту деятельности генов vir-области — гистидиновой протеинкиназе, которая активирует транскрипцию остальных vir- генов. Индукция этих генов обратима, что очень важно для бактерий. Если растительный организм ослаблен или вообще нежизнеспособен, процесс останавливается и Т-ДНК не переносится в такую клетку. Другой продукт генов vir-области — эндонуклеаза, которая отвечает за вырезание Т-ДНК. Белки virB и virE транспортируют Т-ДНК в одноцепочечной форме из бактерии в цитоплазму растительной клетки. Механизм переноса Т-ДНК, по-видимому, аналогичен переносу плазмидной ДНК в процессе конъюгации. Встраивание Т-ДНК в геном клетки растения становится возможным благодаря наличию гомологичных участков между растительной и плазмидной ДНК в местах встраивания. После внедрения Т-ДНК становится обычной частью генома растения и наследуется как доминантный признак в соответствии с законами Менделя (рис. 5.18).

Именно способность участка Ti-плазмиды A. tumefaciens встраиваться и экспрессироваться в геноме растительной клетки послужила поводом для попытки создания на основе этой плазмиды вектора, доставляющего дополнительные гены в клетку. Т-ДНК ограничена с двух сторон повторяющимися последовательностями (фланкирующими последовательностями), по которым и происходит вырезание этого участка ДНК из плазмиды. Казалось бы, что любая ДНК, встроенная между этими последовательностями, будет принята за Т-ДНК и перенесена в растительную клетку любых двудольных растений.
Однако,Ti-плазмида как вектор обладает некоторыми недостатками: большие размеры Ti-плазмиды (от 200 до 800 тыс. п. н.); отсутствие способности реплицироваться в клетках Е. coli, что необходимо для клонирования рекомбинантных плазмид; неспособность трансформированных с помощью Ti-плазмид клеток к регенерации целого растения; неспособность к трансформации клеток почти всех однодольных растений. Основной недостаток — слишком большие размеры Ti-плазмиды, которые делают весьма затруднительными манипуляции с ней во время конструирования вектора. Для решения этой проблемы разработана технология создания промежуточного вектора с применением классического объекта генетической инженерии – Е.coli.
Процесс начинается с создания рекоминантной структутры, которую можно достаточно просто клонировать, т.е. многократно увеличивать число ее копий. Т-ДНК вырезают в помощью рестриктаз из Ti-плазмиды и встраивают в небольшую плазмиду pBR322, способную реплицироваться в клетках E.coli. В этих клетках рекомбинантную ДНК клонируют, после чего встраивают в Т-ДНК дополнительные гены и повторяют клонирование. Полученные многочисленные копии промежуточной векторной ДНК вводят в клетки A. tumefaciens, содержащие обычные Ti- плазмиды. В результате гомологичной рекомбинации Т-ДНК с встроенными в нее дополнительными генами замещает нормальную Т-ДНК в Ti-плазмидах. После этого отбирают с помощью генов-маркеров трансформированные агробактерии и заражают ими растительные клетки. Дополнительные гены вместе с Т-ДНК встраиваются в геном растения, и в конце концов образуется генетически модифицированный организм с заданными свойствами (рис. 5.19). Эту довольно сложную технологию можно упростить, если использовать бинарные векторы.

Бинарные векторы представляют собой бактерии, содержащие две разные Ti-плазмиды. Одна из них несет vir-область и обеспечивает интеграцию в геном растительной клетки Т-области, содержащей любые гены другой плазмиды. В этом случае двойной кроссинговер не требуется.
Векторы на основе ДНК-содержащих вирусов растений. Вирусы можно рассматривать как разновидности чужеродной нуклеиновой кислоты, которые реплицируются и экспрессируются в клетках растений. Подавляющее большинство фитовирусов в качестве носителя генетической информации содержат РНК. Только 1 — 2% вирусов, инфицирующих растения, относятся к ДНК-содержащим. Именно эти вирусы удобны для использования в технологии рекомбинантных ДНК, а также в качестве векторов.
ДНК-содержащие вирусы могут включать одноцепочечную или двухцепочечную ДНК. В качестве представителей первой группы можно назвать вирус золотистой мозаики фасоли (ВЗМФ) или вирус полосатости кукурузы. Наиболее изученный представитель группы вирусов с двухцепочечной ДНК — вирус мозаики цветной капусты (ВМЦК), поражающий в основном растения семейства крестоцветные.
Обычно фитовирусы реплицируются с образованием большого числа копий молекул нуклеиновых кислот — 10 и более молекул на зараженную клетку. Поэтому фитовирусы представляют собой очень эффективные средства для получения хорошей экспрессии чужеродного гена. Кроме высокой копийности вирусной нуклеиновой кислоты вирусные векторные системы имеют еще ряд преимуществ: малый размер генома (возможность легкой мани пуляции вирусной ДНК) и сильные промоторы, обеспечивающие эффективную экспрессию чужеродных генов.
Однако вирусы в качестве векторов обладают и существенными недостатками: имеют небольшую емкость, патогенны и неспособны встраиваться в хромосомы хозяина. Небольшую емкость можно увеличить, если инфицировать вирусом (например, ВМЦК) растительные протопласты, а не клетки. В этом случае инфекция не передается от клетки к клетке, нет необходимости в упаковке ДНК в вирусные частицы. Следовательно, часть вирусного генома, ответственная за упаковку в вирусные частицы, может быть удалена и замещена дополнительной чужеродной ДНК. Другой недостаток — отсутствие способности встраиваться в геном растительной клетки — удается обойти (по крайней мере для ВМЦК) благодаря специальному методическому приему — агроинфекции. Для этого геном ВМЦК встраивают в Т-область Ti- плазмиды и в ее составе интегрируют в ядерный геном различных растений.
Методы прямого переноса генов в растение. Эти методы стали использоваться для растений благодаря появлению специфического объекта — изолированных протопластов, т. е. клеток, лишенных целлюлозной стенки.
Методы прямого переноса генов довольно многочисленны:
Трансформация растительных протопластов. Метод осуществляется благодаря комбинации методик кальциевой преципитации ДНК и слияния протопластов. Для трансформации может быть использован практически любой ДНК-вектор. Донорная ДНК может не содержать специальных биологических сигналов (vir-областей, пограничных областей Т-ДНК).
Заражение культуры протопластов на начальной стадии ее роста агробактериями, которые используют в качестве векторов.
Микроинъекции ДНК. Этот метод аналогичен методу микроинъекций животных клеток. Его можно рассматривать как наиболее универсальный. Эффективность трансформации растительных клеток — 10 — 20 % независимо от типа вектора. Трансформация не видоспецифична, возможен перенос генов в любое растение.
Электропорация. Метод основан на повышении проницаемости биомембран за счет действия импульсов высокого напряжения. В результате молекулы ДНК проникают в клетки через поры в клеточной мембране.
Упаковка в липосомы. Это один из методов, позволяющих защитить экзогенный генетический материал от разрушения нуклеазами растительной клетки. Липосомы — сферические тельца, оболочки которых образованы фосфолипидами.
Метод биологической баллистики. Это один из самых эффективных методов трансформации однодольных растений. Исходный материал для трансформации — суспензионная культура, каллусная ткань или 4 — 5-дневные культивируемые незрелые зародыши однодольных.
Метод основан на напылении ДНК-вектора на мельчайшие частички вольфрама, которыми затем бомбардируют клетки. Бомбардировка осуществляется с помощью биолистической пушки за счет перепада давления. Часть клеток гибнет, а выжившие клетки трансформируются, затем их культивируют и используют для регенерации растений.
5.3 Применение методов генетической инженерии для улучшения аминокислотного состава запасных белков растений
Решение проблемы создания новых форм растений подразумевает в первую очередь повышение качества синтезируемых растением продуктов, которые определяют его питательную и техническую ценность. В основном это касается запасных белков.
В большинстве случаев запасные белки растений имеют несбалансированный для питания человека и животных аминокислотный состав. Так, запасные белки злаков — проламины — бедны лизином, триптофаном и треонином, что снижает их питательную и кормовую ценность. Улучшение аминокислотного состава белка путем традиционной селекции не дает желательных результатов, поскольку необходимые гены часто сцеплены с нежелательными признаками и наследуются вместе. Например, у мутантов кукурузы и ячменя повышение содержания лизина коррелировало с уменьшением синтеза основных запасных белков — зеина и гордеина, а также с уменьшением урожайности.
Операции по получению трансгенных растений с улучшенным аминокислотным составом белка разделены на ряд этапов:
1) клонирование генов запасных белков;
2) изучение механизмов тканеспецифичной и временной экспрессии белков и выявление последовательностей ДНК, определяющих данный механизм;
3) целенаправленное изменение последовательностей генов запасных белков для улучшения аминокислотного состава;
4) создание векторов, содержащих измененный ген;
5) введение модифицированных генов в растения.
В настоящее время клонированы 10 генов гордеинов ячменя, гены а- и б-глиадинов и глютенина пшеницы, зеинов кукурузы, легумина бобовых, пататина картофеля и ряд других. Имеются практические результаты трансформации растений. Так, введение в геном пшеницы модифицированного гена проламина привело к активному синтезу модифицированного белка, а также повлияло на состав и уровень соответствующих запасных белков. В итоге улучшилось хлебопекарное качество пшеничной муки.
5.4. Повышение эффективности процесса фотосинтеза
Один из возможных способов увеличения фотосинтеза и, следовательно, продуктивности растений состоит в клонировании хлоропластных генов в клетках бактерий и их переносе в растения. Известно, что хлоропласты и прокариотические клетки сходны по ряду признаков. На основании этого возникла симбиотическая гипотеза происхождения хлоропластов, впервые выдвинутая А. С. Фаминциным (1886). Согласно этой гипотезе, клетки прокариот и хлоропласты сходны. В них присутствуют кольцевые ДНК, 708-рибосомы; синтез белков начинается с одной и той же аминокислоты — N-формилметионина, а синтез белка подавляется хлорамфениколом, а не циклогексимидом, как у эукариот. Позже было показано, что ДНК-зависимая РНК- полимераза Е. coli связывается с определенными участками ДНК хлоропластов шпината.
В клетках Е. coli инициация белкового синтеза частично регулируется доступностью участка связывания рибосом (УСР). Его структура до конца еще не выяснена, но расшифрован участок, известный под названием «последовательность Шайн—Дальгарно» (ШД). Она комплементарна б-концу 168-рибосомальной РНК, и инициация белкового синтеза начинается с образования комплементарной пары между этой последовательностью и 3′-концом 168-рибосомальной РНК. Анализ последовательности ДНК хлоропластного гена большой субъединицы основного фермента фотосинтеза — рибулозобисфосфаткарбоксилазы — оксигеназы (Рубиско) кукурузы — выявил значительные гомологии с известными промоторами и последовательностями ШД клеток Е. coli. Все это привело к попытке клонирования генов хлоропластов в клетках Е. coli, наиболее часто используемой в генно-инженерных исследованиях.
Транскрипционные конструкции могут создаваться двумя путями: во-первых, это установка промотора рядом с УСР, который узнается полимеразой Е. coli, во-вторых, это формирование гибридного УСР, состоящего из прокариотической последовательности ШД и эукариотического или синтетического инициирующего кодона. Первый путь широко применяется для увеличения экспрессии генов Е. coli и хлоропластных генов в клетках Е. coli.
В настоящее время уже клонировано несколько хлоропластных генов: гены синтеза субъединиц Рубиско, белка хлорофилл-белкового комплекса, АТФсинтетазы, цитохрома и др.
5.5. Генно-инженерные подходы к решению проблемы усвоения азота
Азот — один из самых необходимых элементов для растений. Его недостаток в почве или питательном субстрате часто приводит растение к гибели, поэтому в первую очередь необходимо внесение в почву азотных удобрений. Однако их производство требует очень больших энергетических затрат, поэтому оно дорогостояще. Стоимость азотных удобрений в 6 раз выше стоимости фосфорных удобрений и в 16 раз выше стоимости калийных удобрений. При этом растения используют только от 30 до 70 % внесенных в почву доступных форм азота, остальное просто вымывается из почвы, загрязняя окружающую среду. Гораздо более естественно и доступно снабжение растений азотом путем его биологической фиксации.
Фиксация атмосферного азота (диазотрофность) — свойство прокариотических организмов. Азотфиксирующие организмы делятся на симбиотические (90 %) и свободноживущие (10 %). Фиксация атмосферного азота связана преимущественно с симбиотическими микроорганизмами. В настоящее время известны четыре основные системы симбиоза, имеющие большое значение не только для естественных сообществ, но и для сельского хозяйства, лесоводства. Это Rhizobia — бобовые растения, Azolla-Anabaena — рис, Actinomyces — деревья, Spirillum — травы. Атмосферный азот фиксируется благодаря уникальному ферменту — нитрогеназе.
В 1960 г. американские исследователи показали, что нитрогеназа сохраняет свою активность в бесклеточных экстрактах Clostridium pasteurianum. Это послужило толчком для начала активных исследований биохимии азотфиксации, структуры и механизма действия нитрогеназы. К 1981 г. нитрогеназа была выделена из 36 видов микроорганизмов. Она считается одним из наиболее сложных ферментов, использующих простые субстраты. Кроме азота нитрогеназа может восстанавливать ацетилен, цианистый водород, закись азота и некоторые другие соединения. Восстановление ацетилена в этилен позволило разработать надежный тест для обнаружения азотфиксирующей активности. Непременное условие работы нитрогеназы — ее защита от кислорода, который ингибирует не только активность нитрогеназы, но и ее биосинтез.
Начиная с 1970 г. стали появляться серьезные работы по изучению генов азотфиксации и их переносу в клетки Klebsiella pneumoniae и Е. coli. С помощью техники рекомбинантных ДНК были составлены генетические карты генов азотфиксации (nif-генов), которые показали сходную организацию генов у большей части азотфиксирующих организмов. Было установлено, что nif- гены расположены между генами, кодирующими биосинтез гистидина (his) и генами, ответственными за усвоение шикимовой кислоты (shiA). Гены, кодирующие синтез белковых субъединиц компонентов нитрогеназы, образуют единый оперон (рис. 5.20). В клетках симбиотических бактерий Rhizobium leguminosarum, R. meliloti, R. trifolii плазмиды, кроме структурных генов нитрогеназы, содержат гены, отвечающие за развитие корневых клубеньков у определенных видов бобовых.
Конструирование плазмид, несущих nif-гены, позволяет передавать способность к фиксации азота организмам, не обладающим этим свойством. Среди бактерий, кроме Е. , такой перенос осуществлен для бактерий Salmonella typhimurium, Erwinia herbicola и других. Однако подобные манипуляции могут приводить к нежелательным эффектам. Так, перенос генов в штамм Erwinia (бактерии, вызывающие гниение растений) может усилить его патогенное действие. Кроме того, существует вероятность случайного переноса вместе с nif-генами каких-то нежелательных генов.
В настоящее время внимание ученых привлекают проблемы введения генов азотфиксации в клетки растений, создания ризоценозов между небобовыми растениями (особенно злаками) и азотфиксирующими организмами, повышения мощности корневой системы бобовых растений для увеличения на ней количества клубеньков. Кроме того, предполагается создание новых азотфиксирующих систем путем введения азотфиксирующих микроорганизмов в каллусные ткани растений с последущим образованием из них растений-регенерантов, а также повышение эффективности фиксации азота путем воздействия на гены, контролирующие этот процесс.
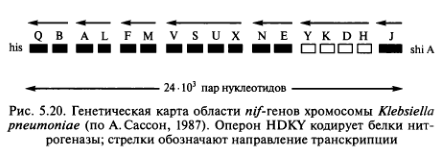
Наиболее интересна первая проблема — введение nif-генов в клетки растений. Однако ее решение сопряжено с рядом трудностей. Основная — разрушение нитрогеназы под воздействием кислорода. У азотфиксирующих микроорганизмов существует ряд приспособлений, защищающих бактерии от свободного кислорода. Среди них присутствие в клетках клубеньков лешглобина — гем- содержащего белка, который встраивается в мембрану бактероида (увеличенной в размере бактериальной клетки, характеризующейся наибольшей способностью к фиксации азота) и регулирует поступление кислорода. Легоглобин кодируется в геноме растительной клетки-хозяина, но его синтез начинается только после проникновения бактерий в эту клетку. У цианобактерий механизм защиты нитрогеназы от кислорода иной. Азотфиксация идет в гетероцистах, а фотосинтез — в обычных клетках. Поэтому кислород, выделяющийся в процессе фотосинтеза, не ингибирует фиксацию азота. Введение только nif -генов в какую-то растительную клетку не решает проблемы. Если нитрогеназа будет синтезироваться в этой клетке, в частности в клетках злаков, то она разрушится под действием кислорода, присутствующего в клетке. Кроме того, сама клетка, в которую переносят гены азотфиксации, может быть не приспособлена к синтезу и расходованию большого количества энергии, которое требуется для фиксации азота.
Таким образом, более перспективно повышение эффективности фиксации азота в уже существующих природных системах за счет воздействия на гены, контролирующие этот процесс, а также увеличение мощности корневой системы бобовых растений и создание новых азотфиксирующих систем с помощью методов клеточной инженерии.
5.6. Изменение качества плодов
В настоящее время найдены способы регулирования сроков созревания плодов с помощью методов генетической инженерии. Для этого используют метод создания антисмысловой РНК, который позволяет управлять работой интересующего гена. В растениях ген PG контролирует синтез полигалактуроназы — фермента, который участвует в разрушении пектина. Данный фермент синтезируется в период созревания плодов томата, они становятся мягкими, что значительно сокращает срок их хранения. Отключение гена PG позволяет получить растения с новыми свойствами — увеличенным сроком хранения и более высокой устойчивостью к грибным заболеваниям. Эту же технологию можно применить для регулирования активности другого гена — гена EFE, продуктом которого является фермент, участвующий в биосинтезе этилена — фитогормона, одной из функций которого служит ускорение созревания плодов. Отключение данного гена также может увеличить срок хранения плодов.
5.7. Устойчивость растений к гербицидам
В сельском хозяйстве широко используют гербициды — химические соединения, применяемые для уничтожения сорной растительности. Гербициды широкого спектра действия могут не только уничтожать сорняки, но и угнетать рост культурных растений. В связи с этим возникает необходимость в создании растений, устойчивых к данным веществам. Существует два подхода к решению этой проблемы: прямая селекция устойчивых к гербицидам мутантных форм растений, или мутантных клеточных штаммов (клеточная селекция), и генно-инженерный метод, который состоит во введении в растения генов гербицид-резистентности растительного или бактериального происхождения.
Изучение механизмов устойчивости служит основой для создания трансгенных растений. Оно включает четыре основных этапа: выявление мишеней действия гербицидов в клетке растений; отбор растений, устойчивых к данному гербициду в качестве источника генов резистентности; идентификация и клонирование этих генов; изучение их экспрессии для использования в трансгенных конструкциях.
Благодаря использованию методов генетической инженерии были созданы новые, устойчивые к различным гербицидам сельскохозяйственные культуры. В геном этих культур вводились мутантные гены, кодирующие синтез ферментов, на которые гербициды (атразин, бромоксилин, имидазол) не оказывают негативного действия. Например, растения лядвенца рогатого (Lotus corniculatus) были трансформированы с помощью штамма А281/рСВЕ21. Эта бактерия содержит плазмиду с встроенным геном bar, кодирующим фермент, придающий устойчивость к гербициду биалофосу. Трансгенные растения содержали ген bar и были невосприимчивы к гербициду (А. М. Стефанович, Г. Н. Ралдугина, 1999). Однако в тканях таких растений наблюдается накопление гербицидов, и использовать эти растения можно только в технических целях. Вместе с тем было показано, что введение генов, кодирующих другие ферменты, позволяет проводить детоксикацию гербицидов, создавая таким образом растения, пригодные в пищу. Так, детоксикация действующего вещества гербицида 2,4-D осуществляется при переносе в растение гена монооксигеназы, глифосата — при введении гена фосфонатазы, бромоксилина — гена нитрилазы.
5.8. Устойчивость растений к фитопатогенам и насекомым
Необходимость создания растений, устойчивых к фитопатогенам, связана с тем, что насекомые-вредители, вирусные и другие заболевания служат причиной значительного снижения урожайности сельскохозяйственных культур.
Наибольший урон растениям наносят грибные, бактериальные и вирусные патогены, насекомые-вредители. В растении существуют защитные механизмы, которые в большей или меньшей степени (в зависимости от устойчивости растений) начинают действовать в ответ на проникновение фитопатогенов в клетку. Во-первых, начинается синтез соединений, вызывающих гибель патогенов. Примером могут служить специфические белки PRP (pathogen related proteins). Из них наиболее изучены ферменты хитиназы и бета-1,3-глюконазы, которые угнетают рост грибов и некоторых видов бактерий, разрушая их клеточные стенки. Во-вторых, могут создаваться структурные барьеры, препятствующие распространению инфекции. Это достигается благодаря лигнификации клеточных стенок. Той же цели — защите клеток — служит присутствие в клеточных стенках белков-экстенсинов и олигосахаридов.
Применение методов генетической инженерии, использующих естественные защитные механизмы, позволяет получать трансгенные растения, устойчивые к грибной, бактериальной и вирусной инфекции. Так, гены хитиназы и глюконазы кодируются одиночными генами. Благодаря этому были получены трансгенные растения табака и турнепса, в состав генома которых ввели ген хитиназы. Лабораторные и полевые испытания выявили большую устойчивость трансгенных растений. В растения томатов был введен ген защитных пептидов редьки (дефензинов) rs, отвечающих за устойчивость к фитопатогенным грибам. Наконец, перспективны клонирование и перенос генов, кодирующих специфические белки (small antibiotic-like proteins), содержащиеся в семенах многих растений. Эти белки защищают семена в период покоя и во время прорастания от грибных и бактериальных инфекций.
Другой подход к получению трансгенных растений, устойчивых к вирусной инфекции, состоит во введении в геном исходных растений гена оболочки вируса. Это приводит к ингибированию размножения вируса и снижению инфицированности. Благодаря такому подходу был получен стойкий антивирусный эффект у растений табака, трансформированных геном оболочки вируса табачной мозаики (ВТМ).
Еще одна группа методов получения трансгенных растений, устойчивых к действию фитовирусов, включает введение и экспрессию генов антивирусных антител, вирусных сателлитных РНК. Интересный эффект дало введение в геном растений гена человеческого интерферона JFN — одного из ключевых белков индукции иммунитета у млекопитающих. С помощью вируса мозаики цветной капусты геном интерферона были трансформированы растения турнепса, табака, картофеля, что повысило устойчивость этих растений к вирусным заболеваниям.
Вполне традиционным для придания устойчивости к насеко- мым-вредителям стало внесение в растения гена Bt бактерий Bacillus thurengiensis. Этот ген отвечает за синтез белка протоксина, который при попадании в кишечник личинок насекомых разрушается. Продукт данного ферментативного расщепления — 5-эндотоксин — вызывает гибель насекомых. Интерес к этой группе белков вызван их широким спектром действия. Найдены новые классы эндотоксинов, которые токсичны к клещам, нематодам, одноклеточным паразитирующим микроорганизмам и т.д. Более того, в настоящее время сконструирован искусственный ген Bt, более эффективный, с более широким спектром устойчивости по сравнению с природным геном.
Другой путь повышения устойчивости растений к вредителям, в частности к фитопатогенным грибам, — это экспрессия в клетках растений генов — ингибиторов протеиназ. Для данной цели перспективно использование гетерологичных генов растений, так как многие ткани и органы растений содержат ингибиторы, специфически настроенные против протеиназ насекомых и грибов, но безвредных для человека и животных.
Еще одно направление создания трансгенных устойчивых растений связано с повышением их иммунитета. У устойчивых растений в ответ на атаку патогенов происходит изменение метаболизма: накапливаются перекись водорода, салициловая кислота, фитоалексины — соединения, выполняющие защитную роль в растении. Поэтому существенное увеличение с помощью изменения генома уровня салициловой кислоты и других соединений в ответ на проникновение фитопатогена может стать перспективным для получения устойчивых растительных организмов.
5.9. Устойчивость растений к абиотическим стрессам
Адаптация растений в природе и, следовательно, их способность к выживанию при неблагоприятных условиях среды обеспечиваются тремя способами. Во-первых, физиологические механизмы, позволяющие растениям избежать неблагоприятные воздействия (например, период покоя). Во-вторых, адаптация осуществляется благодаря морфологическим приспособлениям: толстому слою кутикулы на листьях, уменьшению листовой поверхности, ее опушению, которые предотвращают излишнюю потерю влаги растениями. В-третьих, негативное влияние внешней среды может быть преодолено с помощью изменений метаболизма. Именно этот последний адаптационный механизм наиболее доступен для генно-инженерных исследований. Например, известно, что при водном стрессе у высших растений основным защитным механизмом, связанным с изменением метаболизма, является накопление в клетках пролина, глицинбеатина и других осмопротекгоров.
Экспериментально было показано, что стрессовый ответ у бактерий и высших растений выражается сходно. И у растений, и у бактерий начинается усиленный синтез молекул осмопротекторов, механизм действия которых состоит в установлении осмотического баланса между цитоплазмой и окружающей средой, а также стабилизации белковых молекул. В бактериях биосинтез пролина хорошо изучен, известны гены, кодирующие ферменты этого процесса. Избирательная экспрессия генов осмопротекторов может привести к увеличению адаптационных качеств растения и, следовательно, к увеличению его продуктивности. Поэтому следующим шагом на пути создания устойчивых к стрессам растений было клонирование бактериальных генов, получение векторных конструкций на основе Ti-плазмиды и введение их в растения. Полученные трансгены синтезировали и накапливали пролин в 4—6 раз интенсивнее, чем обычные растения. Трансгенные побеги могли укореняться и расти при концентрации соли в среде 20 г/л (350 мМ).
У растений адаптация к низким температурам сопряжена с многочисленными физиологическими изменениями. При этом накапливаются растворимые вещества, понижающие осмотический потенциал клеток и уменьшающие вероятность образования крупных кристаллов льда. Кроме того, синтезируется большое количество белков с повышенным содержанием сульфгидрильных групп (-SH), которые обладают особо высокой способностью к гидратации, а гидратационная вода, как известно, практически не замерзает. Однако повышение устойчивости растений к замерзанию с помощью методов генной инженерии началось с изменения генома не растений, а бактерий. Исследователи Колорадского университета (США) выяснили, что повреждению растений при замерзании способствуют бактерии эпифитной (поверхностной) микрофлоры Pseudomonas syringae и Erwinia herbicola, белки которых служат центрами кристаллизации. Если обезвредить бактерии стрептомицином, то растения не замерзают при температуре -8 С. Но стрептомицин дорог и вреден, поэтому выгоднее было изменить генетику данного штамма бактерий, вырезав из генома определенный ген. Растения, инфицированные мутантным штаммом P. syringae, росли при отрицательной температуре. Однако оказалось, что бактерии мутантного штамма более живучи и способны вытеснить природный штамм, который, попадая в верхние слои атмосферы, способствует кристаллизации атмосферной влаги. Вероятно, уничтожение природного штамма могло бы привести к экологической катастрофе.
Следует отметить, что работы по генетической инженерии, возможности манипулирования генами растений представляют огромный интерес для фундаментальных исследований. Эти работы позволяют изучать основы молекулярной и клеточной биологии растительной клетки, глубинные механизмы процессов, происходящих в ней. Вместе с тем нельзя не задуматься о своевременности прикладного применения результатов генно-инженерных исследований.
