ФИЗИОЛОГИЧЕСКИЕ МЕХАНИЗМЫ СТАРЕНИЯ
2.1. Ограничение калорийности питания и старение
2.2. Иммунологическая теория старения
2.3. Элевационная теория старения
2.4. Роль эпифиза в механизмах старения
2.1. Ограничение калорийности питания и старение
В 1914 г. профессор Харьковского университета (а до этого -С.-Петербургского ун-та) Е.А.Шульц, изучая регенерацию гидр и планарий (в том числе вызванную голоданием), пришел к выводу, что в ходе этого процесса клетки животных дедифференцируются и переходят в эмбриональное состояние, т.е. молодеют. Скорость же старения ткани по его мнению зависит от того, как часто она подвергается физиологическому обновлению, периодически голодающие животные достигают большей продолжительности жизни, чем неголодающие. Взгляды Шульца были достаточно известны в первой четверти XX в., однако тогда исследование голодания как фактора продления жизни не получило достаточного развития.
В 1917 г. Osborn описал замедление возрастного выключения репродуктивной функции у крыс, содержавшихся в условиях ограниченного питания. В 30-е годы работами McCay было установлено, что диета с ограничением калорий увеличивает на 30-50% максимальную и среднюю продолжительность жизни крыс и мышей. До 60-70 гг. этот феномен, хотя и был воспроизведен во многих лабораториях, в том числе и в СССР, рассматривался как научный курьез. Однако в последующем эта модель, благодаря своей простоте и устойчивой воспроизводимости стала одной из ведущих в изучении фундаментальных механизмов старения и увеличении продолжительности жизни, хотя при этом наблюдалось замедление не всех возрастных биохимических, физиологических и поведенческих параметров. Ограничение калорийности питания увеличивало продолжительность жизни также у рыб, амфибий, дафний, насекомых и других беспозвоночных. Хотя до сих пор нет ответа на вопрос — замедляет или нет ограниченная диета возрастные процессы у человека и влияет ли на продолжительность его жизни, в трех больших исследованиях на приматах (главным образом, на макаках резус) получены первые свидетельства тому, что по крайней мере некоторые физиологические эффекты ограниченной по калорийности диеты, наблюдаемые у грызунов, воспроизводятся и у обезьян. Среди этих эффектов — уменьшение уровня глюкозы и инсулина в крови, снижение температуры тела, снижение энергозатрат.
Было установлено, что именно общее снижение потребления калорий, а не какого-либо ингредиента пищи определяет геропротекторный эффект голодания (рис.3).
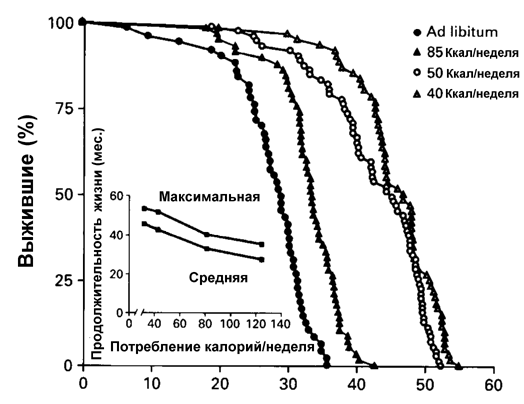
Подсчитано, что 80-90 % из примерно 300 изученных у грызунов, содержащихся на ограниченном по калорийности рационе, разнообразнейших параметров, включая поведение и обучаемость, иммунный ответ, экспрессию генов, активность ферментов и действие гормонов, толерантность к глюкозе, эффективность репарации ДНК, скорость синтеза белка, проявляли черты замедленного старения. Важно подчеркнуть, что такая диета стимулирует апоптоз, который элиминирует пренеопластические клетки в тканях организма, замедляет накопление в них мутаций замедляет развитие и возрастной патологии, включая возникновение новообразований.
Предполагается, что в механизмах увеличения продолжительности жизни при ограничении калорийности питания основную роль играют такие факторы, как замедление роста, уменьшение содержания жира в теле, замедление нейроэндокринных или иммунологических возрастных сдвигов, увеличение репарации ДНК, изменения скорости биосинтеза белков и экспресии генов, снижение температуры тела и основного обмена, ослабление окислительного стресса. Некоторые из этих механизмов, по-видимому, имеют меньшее, если какое-либо, значение. Так, поскольку ограничение калорийности диеты, начатое в возрасте 12 мес., также увеличивает максимальную продолжительность жизни, очевидно, что замедление скорости роста несущественно для продление жизни. Весьма относительно и значение роли снижения содержания жира в теле, поскольку его связь с максимальной продолжительностью жизни у грызунов, содержащихся при питании без ограничения неочевидна, а при ограниченном питании — прямо пропорциональна. Довольно противоречивы данные в отношении роли уменьшения скорости метаболических процессов при ограниченной калорийности питания.
Пожалуй, наиболее значимым эффектом ограниченного по калорийности питания является уменьшение интенсивности свободнорадикальных процессов. У грызунов, содержащихся на такой диете, наблюдается замедление возрастного усиления скорости генерации супероксида и Н2О2, уменьшение окислительных повреждений и замедление возрастного снижения вязкости мембран. Активность ферментов антиокислительной защиты в различных тканях изменяется не столь единообразно, однако голодание снижает чувствительность тканей in vitro к острому оксидативному стрессу. Наибольший защитный в отношении окислительного стресса эффект ограниченного по калорийности питания проявляется в постмитотических клетках головного мозга, сердца и скелетных мышц. При ограничении калорийности рациона не наблюдается возрастного снижения функции эпифиза, гормоны которого играют важную роль в антиокислительной защитной системе организма и обладают отчетливым геропротекторным эффектом.
Следует отметить, что с помощью некоторых фармакологических средств, в частности, антидиабетических бигуанидов (фенформин, буформин), которые повышают чувствительность тканей к инсулину, улучшают толерантность к углеводам, снижают уровень липидов и устраняют явления метаболической иммунодепрессии, также удается увеличить продолжительность жизни мышей и крыс и снизить у них частоту развития спонтанных новообразований.
2.2. Иммунологическая теория старения
Известно, что с возрастом учащаются случаи различных инфекционных заболеваний, аутоиммунных процессов и опухолей. Возможно, это частично обусловлено возрастными дефектами иммунной системы. Связь столь широкого круга связанных с возрастом патологических процессов с дефектами иммунной системы привела к появлению предположения, что старение иммунной системы может ограничивать продолжительность жизни. Однако, несмотря на то, что выполнено множество экспериментальных и клинических исследований, cвидетельствующих о возрастном истощении иммунной системы, имеющихся данных все же недостаточно для объяснения всех проявлений старения. Множество клеточных и гуморальных компонентов, вовлекаемых в иммунные реакции, и большое число модулирующих неиммунных факторов, которые также могут изменяться в старости не позволяют и сегодня нарисовать исчерпывающую картину иммуностарения.
Иммунная и гемопоэтическая система тесно связаны, поскольку имеют единое происхождение от общих поливалентных стволовых клеток. Обе играют ключевую роль в защите организма, предупреждении развития опухолей и возникновении ответа на инфекционные агенты. Однако оказывается, что с возрастом основной гемопоэз у животных и у человека или не изменяется, или изменяется минимально. Резервные возможности могут сужаться, что приводит к снижению способности реагировать на стрессорное воздействие. Периферические лимфоидные органы, такие как селезенка и лимфоузлы, с возрастом не претерпевают закономерных изменений в размерах. Возраст не вызывает каких-либо поражений костного мозга. Продукция стволовых клеток, как правило, хорошо сохранена в старом возрасте, хотя и имеются данные о слабых изменениях скорости их репликации. Считается, что инволюция тимуса, начинающаяся при половом созревании, является главным возрастным изменением иммунной системы. Такая инволюция состоит в прогрессивной потере клеточности с истощением лимфоидного пула клеток в зонах коры и кистозными изменениями эпителиальных клеток. Они являются источником различных пептидов, вовлекаемых в дифференцирующиеся лимфоидные клетки (Т-клетки) из более молодых лимфоидных клеток. Выход дифференцированных Т-клеток снижается с увеличением возраста. Прогрессивно снижаются синтез и секреция полипептидных гормонов тимуса, таких как тимозин, тимопоэтин и тимулин. Считается установленным, что снижение эндокринной активности тимуса играет ключевую роль в возрастных дисфункциях иммунной системы, поскольку заместительная терапия введением гормонов способна восстановить различные иммунные функции в старости. Обмен цинка, который играет существенную роль в иммунокомпетенции, в старости снижается, тогда как добавки цинка могут восстановить иммунные функции.
Зрелые Т-клетки, лимфоциты (В-клетки) костного мозга и естественные клетки-киллеры (NK-клетки) могут быть определены в крови и лимфоидных органах с помощью специфических моноклональных антител. У человека с помощью этого метода не выявлено существенных изменений соотношения различных субпопуляций лимфоцитов. Однако обнаружены серьезные изменения функционирования Т-лимфоцитов. В то время как общее количество Т-клеток в периферической крови в старости заметно не изменяется, наблюдаются четкие различия в относительном количестве подтипов Т-клеток. Количество незрелых лимфоцитов Т-предшественников увеличивается с возрастом, так же как и процент частично активированных Т-лимфоцитов, несущих маркеры незрелого фенотипа тимуса. Имеет место относительное увеличение цитотоксических супрессорных Т-клеток и уменьшение количества хелперов/индукторов Т-клеток. Функциональные дефекты клеточно-опосредованного иммунитета коррелируют с уменьшением популяции хелперов/индукторов. Клетки, полученные от старых людей или лабораторных животных, менее способны к ответу на аллогенные лимфоциты, фитогемагглютинин, конканавалин А и растворимый антиген. Лимфоциты от более старых мышей обладают меньшей способностью вызывать реакции отторжения, чем те, которые получены от более молодых особей тех же инбредных линий. Половина здоровых людей в возрасте старше 50 лет страдает кожной гиперчувствительностью. Уменьшение количества хелперов/ индукторов Т-клеток и функций клеточно-опосредованного иммунитета сопровождается ростом количества антител и аутоиммунных реакций.
Труднее выявить возрастные изменения гуморального иммунитета (функция В-клеток). Исследования влияния возраста на продукцию антител дают противоречивые результаты, возможно, из-за широкой вариабельности этих показателей, характерной для стареющих индивидуумов. Однако твердо установлено, что старение значимо ассоциируется с присутствием различных антител, особенно антител против ядерных антигенов. Получены также доказательства, что старение влияет на скорость продукции антител активированными В-клетками.
Что касается функциональных изменений, то их нарушения отмечены на различных уровнях. Во-первых, способность к пролиферации Т-клеток старых индивидуумов, как правило, снижена, вне зависимости от стимуляции (антигенами, митогенами), и дефект касается как снижения числа клеток, отвечающих на стимуляцию, так и преждевременного истощения мощности клона отвечающих клеток. Во-вторых, подавляется ответ на многие интерлейкины, которые физиологически опосредуют модуляцию пролиферативной реакции. Этот феномен был зарегистрирован не только в отношении Т-клеток, но также и для NK-клеток, которые менее чувствительны в старом возрасте к действию интерлейкина-2 или интерферона. В отношении вспомогательных клеток (фагоцитов, макрофагов) известно, что их количество и функция не изменяются с возрастом, а при определенных обстоятельствах оказывается, что их активность усиливается.
Важным достижением в изучении механизмов иммуностарения стало установление роли в его развитии возрастных изменений в нервной и эндокринной системах. Связь между нервной и иммунной системами
опосредуется гормонами и нейромедиаторами, которые достигают лимфоидных органов и клеток через кровь или прямые связи с вегетативной нервной системой. Нейроэндокринно-иммунные взаимодействия осуществляются циркуляцией гуморальных факторов эпифизарно-гипоталамо-гипофизарной системы либо непосредственно нейропептидами и гормонами, либо опосредованно через действие компонентов этой системы на секрецию гормонов периферических эндокринных желез, которые также обладают иммуномодулирующей активностью. В экспериментах было продемонстрировано, что воздействие на старых животных гормонами щитовидной железы, гормоном роста и аналогами гормона, высвобождающего ЛГ, способно индуцировать реактивацию эндокринной функции тимуса восстанавливать различные связанные с возрастом периферические иммунодефициты, такие как функциональная полноценность Т-клеток, цитотоксичность NK-клеток.
По-видимому, нейроэндокринная система действует не только как модулятор иммунной системы, но также как мишень для сигналов, генерируемых в иммунной системе. Примерами подобных
взаимодействий являются изменения нейроэндокринного баланса, которые могут быть индуцированы или удалением соответствующих лимфоидных органов (например, тимуса), или нарушением функции
иммунной системы в результате реагирования на иммуногенные или толерогенные дозы антигена. Кроме того, зрелые лимфоидные клетки, стимулируемые антигеном, продуцируют гуморальные факторы, сходные (если не идентичные) с классическими гормонами и нейромедиаторами (такими как AКТГ, ТТГ, гормон роста, пролактин, гамма-адреналины). Эти реципрокные связи между нейроэндокринной и иммунной системами имеют место в течение всей жизни, но приобретают особое значение в период старения.
В последние годы было установлено, что некоторые иммуномодуляторы, в частности, пептидные препараты тимуса могут восстанавливать компетентность иммунных клеток в старом организме и увеличивать продолжительность жизни животных.
2.3. Элевационная теория старения
К одной из самых ярких и глубоко разработанных концепций в геронтологии по праву следует отнести элевационную теорию старения и формирования возрастной патологии у высших организмов, придающей ключевое значение в этих процессах возрастному повышению порога чувствительности гипоталамуса к гомеостатическим сигналам. На основании изучения возрастной динамики у женщин таких показателей, как состояние репродуктивной функции, наличие приливов, избыток веса тела и уровень холестерина В.М.Дильман еще в начале 50-х годов выдвинул и обосновал идею о существовании единого регуляторного механизма, определяющего закономерности возникновения и развития в организме в процессе его онтогенеза различных гомеостатических систем. Таким механизмом, по его определению, является возрастное повышение порога чувствительности гипоталамуса к регуляторным гомеостатическим сигналам. На протяжении 60-80-х годов в серии экспериментальных исследований и клинических наблюдений было установлено, что именно этот процесс приводит к возрастному включению и выключению функции репродуктивной системы в женском организме, к возрастным изменениям в гипоталамо-гипофизарно-надпочечниковой системе, обеспечивающей тонический уровень глюкокортикоидных гормонов в крови, их циркадный ритм и повышение секреции при стрессе, и, как следствие, развитию состояния, обозначенному как «гиперадаптоз». Следствием аналогичных возрастных изменений в системе метаболического гомеостата, регулирующего аппетит и энергетическое обеспечение функций организма, является нарастание с возрастом содержания жира в теле, снижение чувствительности тканей к инсулину (пре-диабет) и развитие атеросклероза.
Важным этапом в развитии элевационной теории было установление роли возрастных изменений, закономерно возникающих в этих трех основных «супергомеостатах» (репродуктивном, адаптационном и метаболическом), в формировании таких имеющих ключевое значение для продолжительности жизни индивидуума феноменов, как метаболическая иммунодепрессия и канкрофилия, то есть, формирование условий, способствующих возникновению злокачественных новообразований. Развивая и углубляя на протяжении почти 40 лет свою концепцию, В.М.Дильман пришел к убеждению, что старение (и главные болезни, сцепленные со старением) не запрограммировано, а является побочным продуктом реализации генетической программы развития и поэтому старение возникает с закономерностью, свойственной генетической программе. Выдвинутая им онтогенетическая модель развития возрастной патологии открыла новые подходы к профилактике преждевременного старения и болезней, связанных с возрастом и являющихся основными причинами смерти человека (как писал В.М.Дильман «главных» болезней): болезней сердца, злокачественных новообразований, цереброваскулярной патологии, метаболической иммунодепрессии, атеросклероза, сахарного диабета пожилых и ожирения, психической депрессии, аутоиммунных заболеваний, гиперадаптоза и некоторых других. Из онтогенетической модели возникновения болезней следует, что их развитие можно затормозить, если стабилизировать состояние гомеостаза на уровне, достигаемом к окончанию развития организма. Если замедлить скорость старения, то как полагал В.М. Дильман, возможно увеличить видовые пределы жизни человека.
Современные представления о механизмах геропротекторного действия ограниченной по калорийности диеты, антидиабетических бигуанидов, пептидов эпифиза и мелатонина, некоторых нейротропных препаратов (в частности, L-ДОФА и ингибитора моноаминокосидазы депренила), янтарной кислоты свидетельствуют о перспективности такого подхода.
2.4. Роль эпифиза в механизмах старения
Наиболее существеным для живой природы явлением на Земле является смена дня и ночи, света и темноты. Вращение ее вокруг своей оси и одновременно — вокруг Солнца, отмеряет сутки, сезоны и годы нашей жизни. Все больше сведений накапливается и о роли эпифиза (шишковидной железы) как основного ритмоводителя функций организма. Свет угнетает продуцию и секрецию мелатонина и поэтому его максимальный уровень в эпифизе и крови у человека и животных многих видов наблюдается в ночные часы, а минимальный — в утренние и днем. При старении функция эпифиза снижается, что проявляется прежде всего нарушением ритма секреции мелатонина и снижением уровня его секреции. Если эпифиз уподобить биологическим часам организма, то мелатонин можно уподобить маятнику, который обеспечивает ход этих часов и снижение амплитуды которого приводит к их остановке. Пожалуй, более точно будет сравнить эпифиз с солнечными часами, в которых мелатонин играет роль тени от гномона — стержня, отбрасывающего тень от солнца. Днем солнце высоко — и тень коротка (уровень мелатонина минимален), в середине ночи — пик синтеза мелатонина эпифизом и секреции его в кровь. При этом, важно то, что мелатонин имеет суточный ритм, то есть единицей его измерения является хронологический метроном — суточное вращение Земли вокруг своей оси.
Если эпифиз — солнечные часы организма, то, очевидно, любые изменения длительности светового дня должны существенным образом сказываться на его функциях и, в конечном счете, на скорости его старения. Изменение длительности светового дня существенно модифицирует функции организма, в частности, репродуктивную и иммунную, развитие возрастной патологии и, в конечном счете, может сказываться на продолжительности жизни. Важно отметить, что нарушение циркадианных ритмов с возрастом имеет существенное значение для продолжительности жизни. Недавно было установлено, что хомячки, имеющие специфические мутации taus/+ в циркадианном осцилляторе супрахиазматического ядра (СХЯ) живут меньше, чем их не имеющие такой мутации собратья, тогда как пересадка от них в гипоталамус эмбрионального СХЯ восстанавливают выживаемость мутантов до нормы.
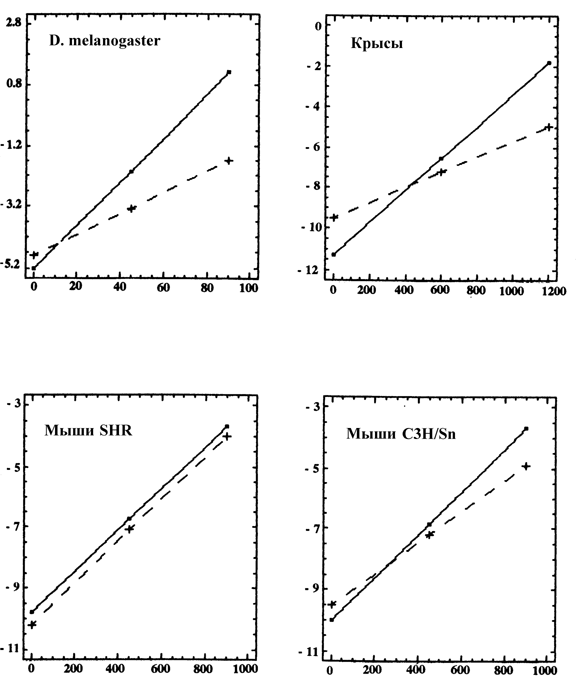
В 1959 г. впервые было установлено, что удаление эпифиза в молодом возрасте приводит к существенному уменьшению продолжительности жизни крыс по сравнению с контролем. Эти данные были подтвержены и другими авторами. В 1960 г. румынский геронтолог К.Пархон упомянул в своей книге о продлении жизни старых крыс с помощью вытяжки из эпифиза. В статье, oпубликованной нами в 1973 г., сообщалось о том, что пептидный экстракт эпифиза (получивший позднее название эпиталамин), восстанавливает у старых самок крыс регулярные эстральные циклы и чувствительность их гипоталамических половых центров к эстрогенам — механизм, которому придается ведущая роль в возрастном выключении репродуктивной функции. Тогда же нами были начаты исследования влияния этого препарата на продолжительность жизни самок крыс. Было обнаружено, что эпиталамин увеличивает длительность репродуктивного периода и на 25 % — среднюю продолжительность жизни животных. Более того, он восстанавливает у части старых самок крыс способность к деторождению. Было показано также, что эпиталамин улучшает чувствительность тканей к инсулину, снижает порог чувствительности гипоталамуса к торможению глюкокортикоидами, замедляет возрастное снижение иммунных функций у животных и увеличивает продукцию вилочковой железой ее гормонов. На мышах двух линий было отмечено увеличение почти на треть средней продолжительности их жизни. В этих опытах введение препарата начинали в возрасте расцвета организма, прежде всего, его репродуктивной и иммунной функций — в 3 — 3,5-месячном возрасте, что соответствует примерно 25-30 годам человека. На мышах и крысах были проведены опыты, в которых препарат начинали вводить в возрасте, предшествующем выключению репродуктивной функции. Оказалось, что и в этом случае эпиталамин существенно увеличивал продолжительность жизни животных. Следует подчеркнуть, что во всех упомянутых наших опытах применение эпиталамина наряду с увеличением продолжительности жизни сопровождалось уменьшением частоты развития опухолей. Эпиталамин эффективно замедлял старение D.melanogaster (рис. 4). Весьма перспективны результаты применения эпиталамина в клинической практике для профилактики преждевременного старения и развития возрастной патологии у человека.
В 1987 г. Pierpaoli и Maestroni сообщили о том, что старые мыши, которым с питьевой водой на ночь давали мелатонин, жили на 20 % дольше контрольных и выглядели явно бодрее последних. Эти данные были воспроизведены на мышах различных линий и крысах, хотя геропротекторный эффект мелатонина не был одинаков и иногда отсутствовал. Пересадка в вилочковую железу или область эпифиза старых мышей эпифиза от молодых доноров также приводила к увеличению продолжительности жизни животных. Основные этапы изучения роли эпифиза в старении приведены в таблице 4.
Таблица 4. Основные этапы изучения роли эпифиза как часов старения
| Год | Обнаруженное явление | Авторы |
| 1958 | Морфологические признаки возрастной инволюции эпифиза | А.М.Хелимский |
| 1959 | Удаление эпифиза уменьшает продолжительность жизни крыс | Malm и соавт. |
| 1960 | Вытяжка из эпифиза увеличивает продолжительность жизни старых крыс | К.И.Пархон |
| 1973 | Полипептидный экстракт эпифиза восстанавливает репродуктивную функцию у старых крыс | В.Н.Анисимов и соавт. |
| 1979 | Полипептидный препарат эпифиза увеличивает продолжительность репродуктивной функции и на 25 % среднюю продолжительность жизни (СПЖ) самок крыс | Dilman и соавт. |
| 1980-1981 | Возрастное снижение синтеза и секреции мелатонина эпифизом | Reiter и соавт. Touitou и соавт. |
| 1982 | Эпиталамин увеличивает на 31 % СПЖ самок мышей C3H/Sn | Anisimov и соавт. |
| 1987 | Введение мелатонина старым мышам C57Bl на 20 % увеличивает их СПЖ | Pierpaoli, Maestroni |
| 1990 | Применение эпиталамина в гериатрической практике | Морозов В.Г., Хавинсон В.Х. |
| 1990 | Эпиталамин увеличивает ночной синтез и секрецию мелатонина эпифизом у молодых и старых крыс | Бондаренко Л.А., Анисимов В.Н. |
| 1991 | Пересадка эпифиза в тимус старых мышей увеличивает их СПЖ | Pierpaoli и соавт. |
| 1993 | Обнаружение антиоксидантных свойств мелатонина | Reiter |
| 1994 | Пересадка эпифиза от молодых мышей старым на место удаленного эпифиза увеличивает СПЖ | Lesnikov, Pierpaoli |
| 1995 | Обнаружение антиоксидантных свойств эпиталамина | Анисимов и соавт. |
| 1997 | Эпиталамин и мелатонин увеличивают СПЖ и замедляют скорость старения у D. melanogaster | Анисимов и соавт. |
Механизмы геропротекторного действия мелатонина и эпиталамина полностью не известны. Существенную роль могут играть способность этих веществ угнетать свободнорадикальные процессы в организме. Как мелатонин, так и эпиталамин стимулируют клетки иммунной системы организма и замедляют старение иммунной системы, они нормализуют ряд возрастных нарушений жиро-углеводного обмена, продлевают циклическую деятельность яичников у самок мышей и крыс, восстанавливают репродуктивную функцию у старых животных. Важным, если не самым важным, свойством этих препаратов является их способность предупреждать развитие как спонтанных, так и индуцируемых различными химическими канцерогенами и ионизирующей радиацией новообразований.
