Физические и химические свойства воды. Показатели качества воды
- 1.1. Состав воды и ее строение
- 1.2. Особенности физико-химических свойств воды
- 1.3. Диаграмма состояния воды
- 1.4. Структура и свойства льда
- 1.5. Физические свойства воды
- 1.6. Химические свойства воды
- 1.7. Вода в связанном состоянии
- 1.8. Замерзание воды и водных растворов в различных условиях
- 1.9. Показатели качества воды
Одним из важнейших химических соединений для человечества является вода. Вода, занимая почти 75 % поверхности Земли, является самым обильным и ценным ресурсом. Мировые запасы воды огромны – около 1389 млн. км 3 . Если распределить их поровну, то на каждого жителя планеты пришлось бы по 280 млрд. литров. Однако 97 % водных ресурсов приходится на долю океанов и морей, в которых вода слишком соленая. Оставшиеся 3% – пресные воды. Вода составляет от 50-97 % веса всех растений и животных и около 70 % веса человеческого тела. Все химические реакции в организме протекают только в водной среде.
Из всей пресной воды человечество может использовать лишь 0,003%, так как она либо сильно загрязнена, либо залегает на больших глубинах и ее нельзя извлечь по приемлемым ценам, либо содержится в айсбергах, полярных льдах, в атмосфере и в почве.
Вода находится в постоянном круговороте (рис.1). Этот естественный процесс рециркуляции происходит до тех пор, пока потребление воды не становится интенсивнее, чем восполняются ее запасы и пока не превышен объем отходов, делающий воду непригодной. Существует два источника пресной воды поверхностные воды и грунтовые воды.
Рис. 1. Круговорот воды в биосфере

Критериями использования воды служат показатели водозабора и водопотребления. Почти три четверти добываемой в мире воды идет на орошение, остальная вода используется в промышленности и коммунальном хозяйстве, для охлаждения оборудования на электростанциях и т.д.
На выращивание одной тонны пшеницы необходимо 1500 тонн воды, одной тонны риса – более 7000 тонн, одной тонны хлопка – 10000 тонн. Огромное количество воды требуется для производства продовольствия и различной промышленной продукции. Прежде чем в магазине появится литровая банка консервов из фруктов или овощей, на нее будет истрачено 40 литров воды. Для производства суточной нормы пищевых продуктов на одного человека требуется около 6 м 3 воды.
Различают природную, сточную и денатурированную воду.
- Природная вода – это вода, которая качественно и количественно формируется под влиянием естественных процессов при отсутствии антропогенного воздействия и качественные показатели которой находятся на естественном среднемноголетнем уровне.
- Сточная вода – это вода, бывшая в бытовом, производственном или сельскохозяйственном употреблении, а также прошедшая через какую-либо загрязненную территорию, в том числе населенного пункта.
- Денатурированная или природно-антропогенная вода — природная вода, подвергаемая антропогенному загрязнению, например, путем смешивания со сточной водой.
Человек может существовать без пищи несколько недель, а без воды лишь несколько дней. От поступления воды в живой организм зависит переваривание пищи, циркуляция крови, удаление распадающихся клеток, регуляция кислотно-основного баланса и температура тела. Несмотря на активное участие в процессах обмена вода инертна в физиологическом отношении. Вода участвует в таких процессах, как перестройка молекул и ионов, образование сложных органических молекул, выполняющих биохимические функции, диссоциация молекул, гидролиз соединений, окислительно-восстановительные реакции и т.д. Для инженеров-строителей представляют интерес свойства жидкой воды и льда и особенности их внутреннего строения, формы связанной воды, образование кристаллогидратов и гидрогелей, составляющих основу при твердении вяжущих материалов.
В современном строительстве широко применяются различные вяжущие материалы (цемент, гипс, известь и др.). Вяжущие необходимы для изготовления бетона, строительных деталей и конструкций, скрепления отдельных элементов сооружений, камней, кирпичей. Строительные растворы готовят смешивая с водой вяжущие материалы, пластичность растворов которых обеспечивает их применение для различных строительных работ. Пластичная масса со временем загустевает и превращается в твердое камневидное тело. При замешивании порошкового гипса (СаSО 4 * 0,5Н2О) получают тесто, затвердевающее за счет присоединения воды и образования двухводного гипса:
2(СаSО 4 * 0,5Н2О) + 3 Н2О) =2(СаSО 4 * 2Н2О)
Этот процесс используется для получения перегородочных плит, панелей, слепков с различных предметов и получения известковогипсовых растворов для штукатурных работ. Известковый раствор – смесь гашеной извести с песком и водой, также используют в качестве вяжущего материала. Но в отличие от гипса он затвердевает в результате отщепления воды и образования кристаллического карбоната кальция по схеме:
Са(ОН)2+ СО2= СаСО 3 + Н2О
Сложные процессы гидратации и поликонденсации составных частей цементного клинкера происходят только при его смешивании с водой и способствуют постепенному затвердеванию и образованию высокомолекулярных силикатов и алюминатов кальция. Например, однокальциевый алюминат сначала гидратируется:
СаО * А12О 3 + 10 Н2О = СаО * А12О 3 *10Н2О
Образовавшийся гидроалюминат кальция переходит в более устойчивый кристаллический двухкальциевый гидроалюминат с выделением гидроксида алюминия:2(СаО * А12О 3 *10Н2О) + Н2О =2СаО * А12О 3 * 8Н2О +2А1(ОН) 3
Прочность цементного камня нарастает с большой скоростью.
Свойства воды
1.1. Состав воды и ее строение
Н2О (оксид водорода) – устойчивое соединение, с массовой долей водорода 11,10 % и кислорода – 88,91 %. Известно до 36 разновидностей молекул воды, состоящих из сочетаний изотопов водорода (протия – 1 1 Н; дейтерия – 21 D и трития – 3 1 Т) и кислорода с массовыми числами от 14 до 19. На долю стабильного изотопа Н2О (где кислород с массовым числом 16) приходится 99,73 % от массы воды. Тяжелая вода D2О получается в результате многократного электролиза обычной воды и отличается по свойствам от обычной воды.
Таблица 1. Свойства обычной и тяжелой воды

Реакции с тяжелой водой происходят значительно медленнее, чем с обычной водой. Тяжелая вода оказывает сильное биологическое воздействие на живые организмы и непригодна для жизненных процессов, так как более прочные связи О – Д изменяют скорости биологических процессов и приводят к смещению равновесия этих процессов. Тяжелую воду применяют в качестве замедлителя нейтронов в ядерных реакторах, а также как источник дейтронов Д + для ядерных и термоядерных реакций, для получения искусственных радиоактивных изотопов, используемых при исследовании механизмов протекания реакций.
Между атомами водорода (1s1) и кислорода (1s2 2s2 2р4) в молекуле воды образуются две ковалентные полярные связи по обменному механизму.

По методу ВС (валентных связей) атом кислорода в молекуле воы находится в состоянии sр 3 -гибридизации. Две гибридные орбитали атома кислорода перекрываются с s-орбиталями двух атомов водорода, а на двух других гибридных орбиталях кислорода располагаются две несвязывающие электронные пары (рис.2а). В результате отталкивания связывающих и несвязывающих электронных пар валентный угол в молекуле жидкой воды равен 105о.
Неподеленные пары электронов кислорода влияют на строение молекулы воды, придавая ей тетраэдрическую структуру (рис. 2б). Орбитали, с неподеленными электронными парами, направлены к противоположным от протонов вершинам тетраэдра. Поэтому около протонов создается пониженная электронная плотность (+), а вокруг орбиталей с неподеленной парой электронов – повышенная электронная плотность (-). а) б)

Рис. 2. Схема структуры молекулы воды
В молекуле воды ядерные центры атомов водорода и кислорода образуют равнобедренный треугольник (рис.3)

Рис. 3. Расстояние между ядрами и угол связи в молекуле жидкой воды
Параметры молекул воды зависят от ее агрегатного состояния (табл. 2).
Таблица 2. Параметры молекул воды

1.2. Особенности физико-химических свойств воды
1. Полярность. Высокая полярность молекул воды объясняется несовпадением центров тяжести ее положительных и отрицательных зарядов. Благодаря необычно большому дипольному моменту (μ (Н2О) = 1,85 Д) вода является химически активным соединением, обусловливающим электролитическую диссоциацию солей кислот, оснований и имеет аномально большую диэлектрическую постоянную, равную 79,5 при 25 о С, т.е. в воде два электрических заряда притягиваются или отталкиваются с силой приблизительно в 80 раз меньшей, чем в вакууме.
2. Наличие водородных связей. Молекулы воды связаны между собой водородными связями. По прочности они занимают промежуточное положение между ковалентными и межмолекулярными связями. Причиной образования водородной связи является смещение единственного электрона водорода к сильно электроотрицательному атому кислорода. При этом водород превращается в частицу с уникальными свойствами:
а) не имеет электрона, а поэтому не отталкивается, а притягивается электронными оболочками других частиц;
б) обладает ничтожно малым размером и, следовательно, большим поляризующим действием. Энергия водородной связи в воде равна 29 кДж/моль. Водородные связи объединяют молекулы воды в ассоциаты (рис.4.)

Ассоциация молекул воды является причиной аномально высоких температур ее кипения, плавления, теплоты парообразования. Известно, что в ряду аналогичных соединений с увеличением молярной массы возрастают температуры плавления и кипения. Однако в случае воды при сопоставлении ее с аналогами эта закономерность нарушается (рис. 5).

Рис. 5. Зависимость температур кипения (I) и замерзания (II) от величины молярной массы вещества для водородных соединений р-элементов (VI) группы
Молекулы воды не образуют ассоциатов в парообразном состоянии. В жидкой воде ассоциированные молекулы могут находиться в равновесии с неассоциированными молекулами. Среднее координационное число молекул в жидкой фазе близко к четырем. В 1932 году Бернал и Фаулер (Англия), основываясь на данных рентгеноструктурного анализа, установили, что связь между молекулами и относительное расположение их в жидкой воде подобно расположению молекул воды в структуре льда. Определить процентное содержание свободных молекул не удалось. Очевидно, что с повышением температуры усиливается тепловое движение и уменьшается степень связанности молекул.
Притяжение молекул воды друг к другу обусловливает большую величину поверхностного натяжения 72,7 мДж/м2. Это значит, что для разрыва водяного столбика диаметром 2,5 см потребуется усилие в 90 тонн. Схема возникновения поверхностного натяжения такова:
молекула А, расположенная внутри жидкости, притягивается соседними частицами с одинаковой силой, т.е. межмолекулярные силы, действующие на молекулу воды, расположенную в объеме фазы, распределены равномерно со стороны соседних молекул;
молекула Б, расположенная на поверхности жидкости, испытывает действие межмолекулярных сил в большей степени со стороны жидкой фазы и почти не взаимодействует с молекулами газообразной фазы. Поэтому каждая отдельная молекула на поверхности жидкости обладает большей энергией по сравнению с энергией молекулы в объеме фазы. Она находится в неравновесном состоянии и стремится втянуться в объем жидкости (рис. 6).
Поэтому небольшие количества воды принимают шарообразную форму, так как из всех геометрических тел одинакового объема шар имеет наименьшую поверхность.

Рис. 6. Схема возникновения поверхностного натяжения на границе раздела двух фаз
Водородные связи влияют на растворимость веществ. В воде хорошо растворяются вещества, имеющие в составе полярные группы или ионную связь, например, спирты, амины, сахара, соли, кислоты, основания, а также некоторые газы NН 3 , СО2, SО2и другие. Структура льда и его свойства также обусловлены водородными связями.
3. Способность к донорно-акцепторному взаимодействию. Вода проявляет свойства донора за счет неподеленной пары электронов атома кислорода. Этим объясняется высокая химическая активность воды и способность ее к комплексообразованию в качестве лигандов. Вода относится к слабым электролитам и поэтому ионизирует в небольшой степени по следующей схеме:

В одной тонне чистой воды содержится 0,1 мг-иона водорода и 1,7 мг-иона гидроксила. Время пребывания водорода в одной из молекул не превышает 10 -8 сек, что указывает на большую скорость диссоциации.
1.3. Диаграмма состояния воды
Вода при 0оС и давлении насыщенного пара 600,5 Па образует три фазы в состоянии равновесия (рис. 7):
ПАР <=> ЛЕД <=> ВОДА
С повышением температуры исчезает твердая фаза – лед, с понижением температуры – жидкая фаза – вода. Система из трехфазной системы становится двухфазной. Тройная точка (0) – место пересечения трех кривых 1, 2, 3 – соответствует нонвариантной системе, т.е. число ее степеней свободы равно нулю. Изобара с давлением 1,013 * 105 Па пересекает кривую I при температуре кипения воды. Точки кривой I соответствуют таким значениям температуры и давления, при которых жидкая вода и водяной пар находятся в равновесии (кривая кипения). Аналогично кривая II – кривая плавления, III – кривая сублимации. Отклонение кривой II к оси ординат с повышением давления указывает на снижение температуры плавления, что обусловлено меньшей плотностью льда по сравнению с водой.

Рис. 7. Схема фазовой диаграммы воды
1.4. Структура и свойства льда
Кристаллы льда имеют гексагональную структуру (рис. 8,а)

Как видно из рисунка 8а в структуре льда есть пустоты, которые могут заполняться другими соединениями, например, одноатомными молекулами газов с образованием соединений включения или клатратов. Каждый атом кислорода тетраэдрически связан с четырьмя другими атомами кислорода (рис. 8б). Между ними располагаются атомы водорода. Два атома водорода соединены с атомом кислорода ковалентной полярной связью (длина связи – 0,099 нм), а два других – соединены водородной связью (длина связи – 0,176 нм), т.е. принадлежат двум другим молекулам воды. В результате образуется рыхлая структура с небольшой плотностью. При плавлении льда водородные связи частично разрушаются (примерно на 10 %), молекулы воды сближаются и плотность воды немного возрастает. При нагревании воды происходит ее расширение, увеличивается расстояние между молекулами и одновременно разрушаются водородные связи, что приводит к уменьшению объема. Поэтому плотность воды проходит через максимум при температуре 3,98оС (рис. 9).

Рис. 9. Изменение плотности воды с температурой (dv/dt – изменение объема данного количества воды с температурой)
Благодаря аномалии в плотности лед плавает на воде. При замерзании на глубине водоемов сохраняется относительно теплая вода (не ниже 4оС), что позволяет существовать живым организмам.
По мере замерзания воды происходит увеличение ее объема (~10 %). Это может привести к нежелательным последствиям, например, к разрыву стальных труб, развитию трещин в скальных породах, разрушению стройматериалов. Наибольший вред приносит периодическое замораживание и оттаивание воды. Учитывая свойства воды, строительные материалы и сооружения из них защищают различными способами.
Необычным свойством льда является его пластичность. Примером проявления пластичности может служить течение горных ледников. Это свойство льда объясняется наличием в его структуре таких сечений, вдоль которых снежные слои кристалла оказываются слабее связанными водородными связями.
1.5. Физические свойства воды
Вода – прозрачная текучая жидкость, не имеющая в чистом виде вкуса, запаха, цвета. Синий цвет морей, озер обусловлен присутствием в воде тонко измельченных твердых веществ. Некоторые свойства воды используются для определения единиц измерения фундаментальных физических величин. Например, в основу стоградусной термометрической шкалы положен интервал между точками замерзания (0оС) и кипения (100оС) воды при давлении 101,3 кПа.
Плотность веществ сравнивают с плотностью воды, выбранной в качестве стандартной. Плотность чистой воды равна 1 г/см 3 при 3,98оС. Благодаря высокой теплоемкости воды 4,18 кДж/(г . град), она выполняет функции регулятора температуры на земном шаре. Вода медленно нагревается и медленно остывает. Поэтому, например, отсутствие воды в пустыне приводит к резким суточным колебаниям температуры (жара днем и холод ночью).
1.6. Химические свойства воды
Наличие неподеленных пар электронов и высокий дипольный момент воды придают ей химическую активность. Вода взаимодействует с большим количеством разнообразных веществ:
1. С инертными газами. При пропускании инертных газов над переохлажденной водой под давлением 150 атм. образуются клатраты или соединения включения типа Ar * 6Н2О, Xе *6Н2О, Кr *6Н2О, устойчивые при низких температурах.
2. С галогенами. Реакции галогенов с водой зависят от окислительной активности галогенов. В ряду F2 – С12– Вr2– I2окислительные свойства уменьшаются, поэтому реакции взаимодействия с водой протекают следующим образом:
Н2О + F2=2НF + О (реакция протекает при обычной температуре)
Н2О + С12<=> НС1 + НС1О (система находится в равновесии)
Н2О + Вr2(I2) <=> НВr + НвrО (равновесие смещено в сторону исходных веществ)
2 Н2О + С12= 4 НС1 + О2(при нагревании)
3. С атомарным кислородом. Н2О + О = Н2О2
4. С фосфором. 6 Н2О +2Р =2НРО 3 + 5 Н2(давление, катализатор)
5. С углеродом и его соединениями. В промышленности эти реакции используются для получения водорода. Н2О (пар) + С (раскаленный) = СО + Н2(смесь СО + Н2– водяной газ) Н2О + СО = СО2+ Н2(катализатор – Fе, 450оС) Н2О + СН4 = СО + 3 Н2(1200 – 1400оС)
6. С металлами.
а) С s-элементами. Реакция протекает при обычных условиях (кроме магния, с которым реакция протекает при 100оС, и бериллия, покрытого прочной оксидной пленкой)2Н2О +2Nа =2NаОН + Н2
б) С металлами средней активности (Fе, Сd, Со, Ni т.д.) Н2О + Fе = FеО + 3Н2(при температуре красного каления)
в)С благородными металлами (Аg, Аu, Рt) и ртутью вода не взаимодействует.
7. С гидридами s-элементов. Н2О + NаН = NаОН + Н2
8. С основными и кислотными оксидами. Н2О + СаО = Са(ОН)2Н2О + SO 3 = Н2SО 4
9. С солями (гидролиз солей) СuС12+ Н2О <=> СuОНС1 + НС1 Сu 2+ + Н2О <=> СuОН + + Н +
10. С различными веществами с образованием гидратов Nа2СО 3 + 10 Н2О = Nа2СО 3 . 10 Н2О
11. С органическими веществами (реакции гидратирования) С2Н 4 + Н2О = С2Н 5 ОН
Термическая устойчивость воды. Вода устойчива к нагреванию, но свыше 1000оС происходит ее термическая диссоциация.
2Н2О <=>2Н2+ О2
Каталитические свойства воды. Некоторые металлы не реагируют с сухим хлором, натрий не окисляется в атмосфере воздуха без следов влаги. Фтороводород в отсутствии влаги не разъедает стекло и т. д.
1.7. Вода в связанном состоянии
Формы состояния связанной воды довольно многообразны. Для строительных специальностей интерес представляют следующие формы: химически связанная вода, вода в кристаллогидратах, вода в гидрогелях, вода, адсорбированная на поверхности твердых тел и капиллярная вода. Рассмотрим более подробно состояния связанной воды без учета переходных форм.
1. Химически связанная вода. В такой форме вода не существует самостоятельно, но может выделиться в свободном виде Например, при нагревании гидроксида кальция происходит диссоциация по следующей схеме:
Са(ОН)2<=> СаО + Н2О
Это гетерогенная реакция с участием твердых веществ — Са(ОН)2, СаО и паров воды. Поэтому константа равновесия определяется концентрацией паров воды или их давлением К = С(Н2О) или К = Р(Н2О)
Иными словами при любой температуре равновесное давление водяного пара является постоянной величиной и не зависит от количеств Са(ОН)2и СаО. Согласно принципу Ле-Шателье равновесие смещается в сторону прямой реакции как при повышении температуры (прямая реакция – эндотермическая), так и при уменьшении влажности воздуха. Зависимость давления диссоциации Са(ОН)2от температуры смещена в сторону высоких температур, что свидетельствует о больших затратах энергии для выделения водяного пара из Са(ОН)2, чем из свободной воды (рис. 10)

Рис. 10. Влияние температуры на давление диссоциации Са(ОН)2
Химически связанная вода содержится в большинстве вяжущих строительных материалов, во многих горных породах, а также в кислородсодержащих кислотах, основных и кислых солях.
2. Вода в кристаллогидратах. Вода, содержащаяся в кристаллогидратах называется кристаллизационной. Количество кристаллизационной воды влияет на устойчивость соединения. Кристаллогидрат с большим содержанием воды устойчив при низких температурах и разлагается при ее повышении, образуя менее гидратированные соединения. Например, при дегидратации гексагидрата хлорида кальция происходят следующие процессы:

В кристаллической решетке молекулы воды связаны и с анионами, и с катионами, кроме того они могут располагаться между слоями, одновременно взаимодействуя с двумя-тремя ионами. Так, слоистая структура двухводного гипса СаSО4 *2Н2О состоит из небольших по размеру катионов Са2+ и крупных анионов SО42-. Молекулы воды располагаются в этом «шахматном поле» через два слоя. С ионом Са2+ вода связывается через атом кислорода (донор), а через водород (акцептор) с кислородом, содержащимся в ионах SО42-.
В условиях высокой температуры устойчивы менее гидратированные или безводные соединения, поэтому при получении вяжущих материалов образуются именно такие формы. При обычной температуре идет гидратация вяжущих материалов в результате взаимодействия как с жидкой водой или водными растворами, так и с водяным паром. Этот процесс способствует образованию пластичной массы вяжущих материалов. Со временем вяжущие материалы превращаются в камневидное тело, твердеют, так как образуются кристаллогидраты (гипс, портландцемент и др.).
3. Вода в гидрогелях. Твердение вяжущих строительных материалов проходит через стадию образования геля – студнеобразной массы. Это полужидкое – полутвердое состояние. Дегидратация геля (его обезвоживание) происходит по-разному: при обычной температуре или при нагревании вода испаряется или вступает в химическое взаимодействие с другими веществами. При этом давление водяного пара над гелем по мере его обезвоживания понижается непрерывно. При одинаковом количестве воды в геле давление водяного пара зависит от его структуры, которая может измениться со временем.
По мере обезвоживания геля изменяются его свойства, пористость. Постепенно гель переходит в твердое камневидное тело с высокой прочностью. Некоторые гели обладают способностью разжижаться при механических воздействиях – перемешивании, вибрировании и т.п. Неоднократное обратимое разжижение геля называют тиксотропией. Процесс тиксотропии используют при твердении бетона.
4. Адсорбированная вода. Многие строительные материалы поглощают своей поверхностью влагу из окружающей среды, в первую очередь из воздуха. Это явление называют адсорбцией. Адсорбция зависит от химического состава, состояния поверхности и от внешних условий (температуры, влажности и т.д.).
Если молекулы воды вступают в химическое взаимодействие с веществами поверхности, то это способствует образованию прочных соединений – хемосорбция. Однако в таком процессе участвует лишь часть воды, так как он ограничен доступной частью поверхности. С помощью специальной обработки состояние поверхности твердого вещества можно изменить таким образом, что оно будет отличаться от внутренних слоев. Это изменение называют химическим модифицированием. Вещества разделяют по отношению к воде на гидрофильные (хорошо смачиваются водой) и гидрофобные (не смачиваются водой) вещества. Соответствующая обработка строительных материалов изменяет их свойства по отношению к воде. С помощью химически модифицированных поверхностей уменьшают или увеличивают гидрофильность или гидрофобность поверхности строительной конструкции, что широко используется в строительной промышленности.
Под влиянием физических факторов вода непрочно адсорбируется поверхностью твердого вещества (физическая адсорбция). Поверхностные частицы твердого вещества (атомы, ионы, молекулы) притягивают подобные им частицы из окружающей среды, создавая силовое поле. Выход частиц из этого поля требует затраты энергии, т.е. «испарение» частиц с поверхности не является свободным. Так как поверхность твердого вещества неоднородна и имеет более или менее активные участки, по отношению к водяным парам, то при небольшой концентрации паров именно они участвуют в поглощении. Однако при повышении концентрации водяных паров оказываются задействованными и другие участки. Следовательно, повышение концентрации водяных паров в окружающей среде способствует увеличению количества адсорбированной воды, которое сильно различается для разных веществ.
Адсорбция – экзотермический процесс, поэтому с повышением температуры количество адсорбированной воды уменьшается. При хемосорбции влияние температуры может быть незначительным. Увеличение поверхности (внутренние поры, капилляры, повышение степени дисперсности) способствует увеличению количества адсорбированной воды, что следует учитывать при использовании строительных материалов.
5. Капиллярная вода. Жидкость, находящаяся в трубке, взаимодействует с ее поверхностью. В стеклянной трубке, опущенной одним концом в воду, столбик воды поднимается выше уровня воды в сосуде, образуя вогнутый мениск (рис. 11).

Рис.11. Стеклянная трубка, опущенная в воду (а) и ртуть(б)
Ртуть в таких же условиях опускается ниже своего уровня в сосуде, образуя выпуклый мениск. Это означает, что поверхность стекла смачивается водой и не смачивается ртутью. Чем меньше диаметр трубки, тем значительнее вышеописанный эффект. Различие уровней воды в трубке и сосуде означает, что давление ее насыщенного пара над этими поверхностями неодинаково. Давление пара над вогнутым мениском в капилляре, стенки которого смачиваются водой, меньше, чем над плоской поверхностью воды во внешнем сосуде. Это приводит к тому, что пар не конденсируется в жидкость на ее плоской поверхности, но конденсируется в капилляре, являясь насыщенным или пересыщенным по отношению к вогнутой поверхности мениска. Это явление называют капиллярной конденсацией, и оно возможно для любой жидкости. На практике роль капилляров могут выполнять поры разного размера и формы. Способность поверхности смачиваться той или иной жидкостью играет решающую роль в капиллярной конденсации.
Перемещение влаги (миграция) в пористых и сыпучих материалах, грунте возможно за счет капиллярной конденсации. При этом в результате миграции система в естественных условиях переходит в более равновесное состояние. Внутри системы достигается одинаковое парциальное давление водяного пара. Если подвергнуть нагреванию часть системы, то происходит перенос конденсированной влаги в более холодные части системы.
1.8. Замерзание воды и водных растворов в различных условиях
В строительстве необходимо учитывать климатические условия и зависимость от них процессов замерзания воды или таяния льда. Замерзание воды в порах строительных материалов при бетонировании, кирпичной кладке и т.п. влияет на их морозостойкость. Природная вода, содержащая различные примеси, при низких температурах ведет себя иначе, чем чистая вода, представляя собой растворы разбавленных электролитов. Следует учитывать и то, что большая часть воды в твердеющих вяжущих материалах находится в связанном состоянии и условия ее замерзания также отличаются от обычной воды.
В результате исследований было доказано, что часть воды в мерзлых грунтах при температуре более низкой, чем 0оС, находится в жидком состоянии, и при нагревании в области низких температур количество такой воды обратимо возрастает. Это свидетельствует о том, что в процессе участвует как свободная, так и связанная вода. В отличие от чистой воды кристаллизация природной воды происходит в некотором интервале низких температур, который может достигать несколько десятков градусов. Между различными формами состояния воды возможно достижение равновесия. Связанная вода обладает давлением равновесного пара (Р), но более низким давлением, чем давление насыщенного пара свободной воды (Р нас. ) при той же температуре. Поэтому температура, при которой связанная вода может находиться в равновесии со льдом, всегда ниже 0 о С (рис.12). Чем сильнее связана вода и, чем ниже поэтому давление равновесного с ней пара, тем ниже температура ее замерзания.

Капиллярная вода обладает давлением пара Р, близким к Р нас. и замерзает почти при 0 о С в относительно широких капиллярах. В более узких капиллярах этот эффект еще заметнее. Можно утверждать, что чем больше отношение Р/Р нас. отличается от единицы, тем больше понижается температура замерзания воды. То же происходит и с адсорбированной водой. При этом следует учесть, что и капиллярная, и адсорбированная вода, находясь в жидком состоянии при температуре ниже 0 о С, является устойчивой равновесной системой и никакие «затравки» в виде льда не способствуют ее кристаллизации. Количество жидкой воды зависит от температуры, а также и от химического состава и структуры грунта. Вода находясь на расстоянии полмикрона от поверхности грунтовых частиц, является свободной и может замерзать и оттаивать почти при 0оС. Исследования показали, что образующаяся при твердении цемента вода в гидрогелях увеличивается в объеме при охлаждении в интервалах 5 – 8оС и –20 –50оС.
1.9. Показатели качества воды
Основными показателями качества воды различных источников являются: физические, химические, биологические и бактериологические. Физические показатели характеризуются как общесанитарные. К ним относятся:
- содержание взвешенных веществ (частиц песка, ила, планктона), которые определяются взвешиванием осадка после его выпаривания, мг/л;
- цветность (окраска) оценивается в условных единицах;
- вкус и запах (обуславливаются растворенными солями, газами, органическими соединениями) оцениваются в баллах (органолептически), либо по порогу разбавления.
Химические показатели условно делятся на пять групп:
1) Основные ионы. Наиболее распространены в природных водах анионы HCO — 3 , SO 4 2- , Cl — , CO 3 2- , HSiO — 3 и катионы Na + ,K + ,Ca 2+ , Mg 2+ , Fe 2+ , они составляют 90-95% от общего содержания ионов в воде. Содержание в воде растворимых солей кальция и магния характеризуют жесткость воды. Различают жесткость карбонатную (Са(НСО 3 )2, Mg(НСО3)2) и некарбонатную (СаSO 4 , MgSO 4 , CaCl2, MgCl2, Ca(NO3)2, Mg(NO 3 )2).
2) Растворенные газы : O2, CO2, H2S и др. Содержание кислорода в воде определяется поступлением его из воздуха и образованием в результате фотосинтеза. Растворимость кислорода зависит от температуры воды, и его концентрация в воде зимой меньше. СО2находится как в растворенном виде, так и в виде углекислоты. Основными источниками СО2являются процессы распада биохимических веществ. H2S бывает органического (продукт распада) и неорганического (растворение минеральных солей) происхождения. H2S придает воде неприятный запах и вызывает коррозию металла.
3) Биогенные вещества. К этой группе относятся необходимые для жизнедеятельности водных организмов и образующиеся в процессе обмена веществ соединения азота и фосфора.
4) Микроэлементы — элементы, содержание которых в воде менее 1 мг/л. Наиболее важные из них йод и фтор.
5) Органические вещества присутствуют в виде гуминовых соединений образующихся при разложении растительных остатков и органических соединений, поступающих со стоком. Их определяют показателями: ХПК (химическое потребление кислорода) и БПК (биологическое потребление кислорода). ХПК – это количество кислорода, которое идет на окисление органики химическим путем в присутствии катализатора (сульфата серебра или дихромата калия), мг/л. БПК – это количество кислорода, которое идет на окисление органики естественным путем (биологическое окисление веществ), мг/л.
К химическим показателям воды относится водородный показатель – рН.
Биологическими показателями качества воды являются гидробионты и гидрофлора. Гидробионты – обитатели от дна до поверхности. Гидрофлора – растительность макро- и микрофиты. Макрофиты – высшая форма растительности. Микрофиты – водоросли. При отмирании макрофитов вода обогащается органическими веществами, ухудшающими органолептические показатели. Микрофиты – продуцируют кислород.
Бактериологические показатели – присутствие болезнетворных микроорганизмов (кишечной палочки). Содержание бактерий группы кишечной палочки в 1 литре воды определяет ее коли-индекс. наименьший объем воды (мл), приходящийся на 1 кишечную палочку называется коли-титром.
Природная вода, как правило, содержит различные примеси: грубодисперсные (песок, глина и т.д.) и коллоидные частицы, органического и минерального происхождения, растворимые и нерастворимые соединения, в том числе и соли. Для получения питьевой и технической воды, используемой в различных отраслях народного хозяйства, необходимо провести ее обработку. Процесс обработки воды обусловлен ее целевым назначением. Так питьевая вода должна соответствовать стандартным требованиям: полная безвредность, приятные органолептические свойства, бактериальная безопасность, жесткость не более 7 ммоль/л. К воде, применяемой для промышленных целей предъявляются менее жесткие требования.
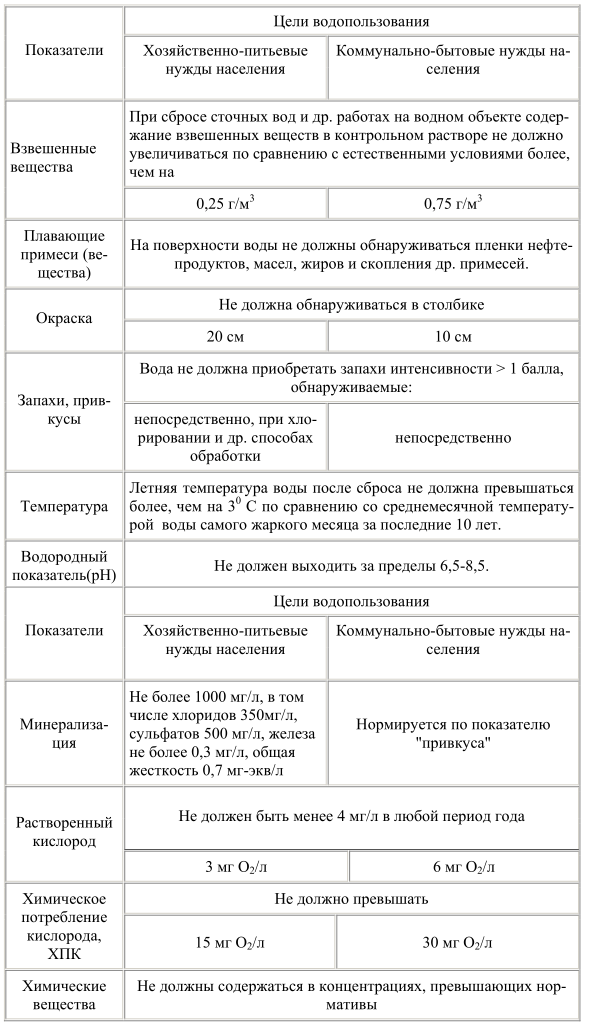
Требования к качеству воды зависят от цели ее использования. В табл. 3 приведены требования к качеству питьевых вод.
Таблица 3 Требования, предъявляемые к качеству воды