Диабетическая болезнь почек
Лекции по нефрологии — Иванов Дмитрий Дмитриевич — 2010
2.1. Диабетическое поражение почек у взрослых
2.2. Диабетическое поражение почек и метаболический синдром у подростков
2.1. Диабетическое поражение почек у взрослых
Увеличение распространенности метаболического синдрома (МС) и сахарного диабета (СД) 2-го типа определило целый круг проблем в современной терапии. Они связаны с необходимостью как профилактики и совершенствования лечения непосредственно МС и СД, так и терапии сопутствующих заболеваний и патологических состояний. Ответственность нефрологов связана с неуклонным увеличением диабетического поражения почек, в первую очередь в виде диабетической и ишемической нефропатии и в меньшей мере — рецидивирующих инфекций мочевой системы. Кроме того, наблюдается постоянное увеличение удельного веса диабета среди причин развития хронической почечной недостаточности.
Так, диабет является причиной терминальной ХПН у 20 % больных в Великобритании и 42 % в США, а среди диализных пациентов документируется у 48 % больных, 90 % из них страдают СД 2-го типа. Диабет может приводить к многочисленным заболеваниям почек.
Нефрологические проявления при диабете:
- Диабетическая нефропатия (гломерулосклероз Kimmelstiel — Wilson)
- Ишемическая нефропатия (атеросклеротический стеноз почечной артерии, холестериновый микроэмболизм)
- Инфекции мочевой системы (папиллярный некроз)
- Гломерулонефрит (мембранозный)
- Функциональная ОПН
- Парез детрузора и обструкция
2003 г. в рекомендациях, в частности US Preventive Services Task Force (2003), указывается на необходимость проведения скрининга для выявления сахарного диабета с 45 лет, а у пациентов с отягощенным анамнезом, избыточной массой тела, гипертензией и гиперлипидемией — с 20 лет. Рекомендации ADA (2005-2008) и KDOQI (2007) нацеливают на ежегодное проведение тестов для выявления микроальбуминурии или соотношения альбумин/креатинин уже через 5 лет после дебюта СД 1-го типа и с момента установления диагноза сахарного диабета 2-го типа. В USPSTF (2008) (рекомендации В) отмечается, что всем пациентам с АД более 135/80 мм рт.ст. как на фоне антигипертензивной терапии, так и без нее следует проводить скрининг на наличие СД 2-го типа (1 раз в 3 года, ADA), оценивая (на выбор) уровень глюкозы натощак, через 2 часа после нагрузки или НЬА1с (рис. 2.2).
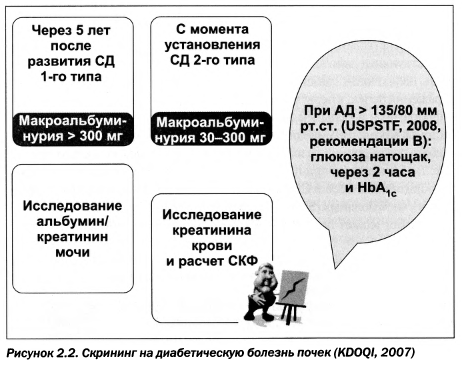
У пациентов с АД 135/80 мм рт.ст. и менее проведение скрининга базируется на понимании того, насколько возможное наличие диабета может повлиять на назначение другого лечения, связанного, например, со снижением уровня липидов крови или применением аспирина для уменьшения проявлений кардиоваскулярных заболеваний. Согласно рекомендациям University of Michigan Health System (2008), скрининг на наличие сахарного диабета 2-го типа следует начинать с 45 лет с 3-летним последующим интервалом, а более молодым лицам — при ИМТ > 25 кг/м2. Диета, физические упражнения и медикаментозные средства позволяют избежать/уменьшить риск развития сахарного диабета 2-го типа (рекомендации А).
Внедрение приведенных рекомендаций позволило стабилизировать ситуацию с увеличением распространенности сахарного диабета и даже выявить тенденцию к ее уменьшению в развитых странах. Напротив, в развивающихся государствах заболеваемость сахарным диабетом продолжает увеличиваться. Актуальность проблемы поражения почек привела к разработке нефрологических рекомендаций KDOQI (2007), в которых предложено для описания поражения почек вследствие сахарного диабета использовать термин «диабетическая болезнь почек (ДБП)» вместо ранее известного «диабетическая нефропатия». Таким образом, диабетическая болезнь почек дополнила группу хронических болезней почек, терминология которых представлена на рис. 2.3.

Диабетическая болезнь почек, не классифицируемая еще по МКБ-Х, является приблизительно в 50 % случаев причиной развития почечной недостаточности. Во многом представляя собой междисциплинарное заболевание, диабетическое поражение почек требует внимания и соответствующей квалификации семейных врачей, интернистов, кардиологов, диабетологов/эндокринологов и нефрологов. Однако независимо от нозологической формы болезни основной причиной смертности пациентов с диабетической болезнью почек и хронической почечной недостаточностью являются кардиоваскулярные события. Именно поэтому увеличение распространенности МС и СД диктуют необходимость поиска эффективных мероприятий по предотвращению развития этих заболеваний, улучшению их выявления и профилактике осложнений.
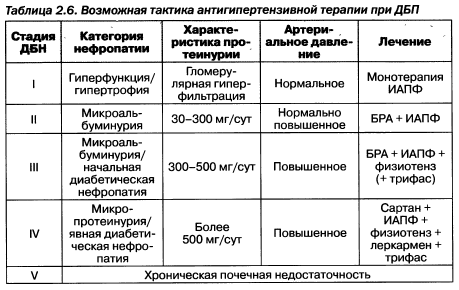
Повреждение почек при диабетической болезни почек происходит постепенно и имеет свою стадийность (рис. 2.4).

Поражение почек при сахарном диабете относится к группе микрососудистых осложнений. Рекомендации ADA (2009), KDOQI (2007), ААСЕ Diabetes Mellitus Clinical Practice Guidelines Task Force (2007), ESC/ ESH (2007) и Joslin Diabetes Center (2006/2007) во многом схожи в подходах, что отражает единство знаний на мировом уровне. Основные положения следующие:
- — необходимость достижения целевого уровня гликемии (НЬА1с < 7, НЬА1с < 6,5 и НЬА1с < 6,2), если не возникает осложнений, связанных с возможностью достижения такого уровня (ADA, 2009) (рекомендации А);
- — необходимость соблюдения диеты; физические нагрузки, отказ от курения (рекомендации А);
- — целевое АД менее 130/80 мм рт.ст. (в том числе для пациентов старше 70 лет) и 125/75 мм рт.ст. при ХБП: микроальбуминурии, рСКФ менее 60 мл/мин (рекомендации А, В);
- — назначение ИАПФ или БРА (рекомендации А), при необходимости недигидропиридиновых кальциевых блокаторов (в том числе для беременных, рекомендации С), (3-блокаторов (карведилол (аР), небиволол: ESC/ESH, 2007) pi диуретиков (рекомендации В). Мониторирование терапии диуретиками и ИАПФ/БРА в зависимости от уровня электролитов и скорости клубочковой фильтрации (рекомендации С);
- — уменьшение белка пищи до 0,8— 1,0 г/кг на начальных стадиях хонической болезни почек и до 0,8 г/кг при прогрессировании ХБП (рекомендации В);
- — диагностирование анемии при НЬ менее 135 г/л у взрослых мужчин и менее 120 г/л у взрослых женщин (рекомендации В);
- — при расчетной СКФ менее 30 мл/мин — направление на консультацию к нефрологу для оценки необходимости почечнозаместительной терапии, включающей проведение трансплантации почки, гемо- или перитонеального диализа (рекомендации В);
- — мониторирование уровня паратиреоидного гормона при уровне рСКФ менее 60 мл/мин с оценкой необходимости назначения активного метаболита витамина D (рекомендации D);
- — контроль липидов и кардиоваскулярных рисков (как влияющих на исход диабетического поражения почек) (рекомендации А).
Говоря о профилактике развития сахарного диабета следует еще раз вспомнить о хорошо известных общих режимных мероприятиях, включающих рациональное питание и физические нагрузки, плановый контроль альбуминурии, уровень липидов крови и АД. Ряд препаратов, среди которых метформин, розиглитазон, статины, ИАПФ и БРА, уменьшают риск развития СД 2-го типа уже при наличии метаболического синдрома. Анализ 22 исследований с участием 143 153 пациентов без СД свидетельствует, что риск развития диабета увеличивается при назначении бета-блокаторов (за исключением небиволола и карведилола, показанных в лечении МС согласно ESC/ESH, 2007) и тиазидных диуретиков. В связи с этим Британский национальный институт здоровья в рекомендациях 2006 года поставил (3-блокаторы и диуретики соответственно на третье и четвертое место, в том числе ввиду возможного увеличения расходов на вновь возникающие случаи сахарного диабета. Приведенные данные позволяют рассматривать первоочередное назначение ИАПФ и БРА в лечении гипертензии у пациентов с МС или семейным риском развития СД, если не возникает необходимости в назначении других антигипертензивных препаратов в связи с другими рисками пациента.
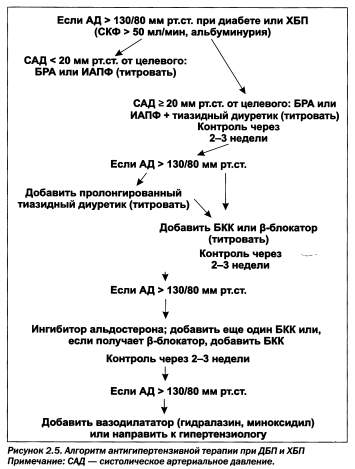
При каком уровне АД следует назначать ИАПФ и БРА у пациентов с диабетической болезнью почек или хроническими заболеваниями почек? Алгоритм ESC предполагает следующую тактику (рис. 2.5).
Назначение ИАПФ/БРА при ранней диабетической нефропатии позволяет ликвидировать микроальбуминурию, а при поздней нефропатии значительно уменьшить ее уровень. При этом целевым АД являются значения менее 130/80 мм рт.ст. (менее 125/75 мм рт.ст. согласно рекомендациям ААСЕ, 2006; ESC, EASD, 2007).
В настоящее время, говоря о целевых значениях, все чаще определяются рекомендуемые интервалы. Так, для уровня гемоглобина крови при хронической болезни почек представлены оптимальные значения не менее 110 г/л и не более 120 г/л, за пределами которых растут кардиоваскулярные риски. Аналогично известным является нижний предел САД менее 100 мм рт.ст. Вероятно, целевой уровень АД может находиться в пределах 100— 125/60—75 мм рт.ст.
Наряду с АД, традиционно микроальбуминурия рассматривается как симптом кардиоваскулярной патологии или поражения почек. Действительно, в зависимости от начального ведущего механизма появления микроальбуминурии следует говорить об эндотелиальной дисфункции (сердечно-сосудистые заболевания и атеросклероз) либо о клубочковой гиперфильтрации (диабетическая и хроническая болезни почек). Знание причины развития микроальбуминурии позволяет корректно подобрать терапию, опираясь на доказательную базу эффективности в лечении конкретного заболевания. Однако в довольно короткие сроки генез образования микроальбуминурии становится смешанным, т.е. дифференцирование значимости вклада каждой из составляющих представляет определенные трудности.
Одновременно суммируются и риски, ведущим из которых является кардиоваскулярный. Именно кардиоваскулярные события приводят к фатальным исходам сердечно-сосудистых заболеваний, диабета и болезней почек, сопровождающихся микроальбуминурией.
В связи с этим возникает важнейший вопрос: что считать микроальбуминурией? Ведь насколько своевременно она будет выявлена, настолько успешными будут режимные и лечебные мероприятия в предотвращении кардиоваскулярной смертности. Согласно существующим руководствам, микроальбуминурия определяется как уровень экскреции альбумина с мочой от 30 до 300 мг/сут (20— 200 мкг/мин). Такой уровень альбуминурии отмечается примерно у 30 % пациентов с сердечно-сосудистыми заболеваниями, гипертензией и диабетом. Однако общеизвестно, что нижний порог микроальбуминурии как патологического симптома завышен. Кардиоваскулярные риски начинают расти по крайней мере с уровня более 4,8 мкг/мин. Поэтому в настоящее время предлагается градация на оптимальную микроальбуминурию (менее 10 мг/сут), нормомикроальбуминурию (10—20 мг/сут) и нормально повышенную микроальбуминурию (20-30 мг/сут). Вероятно, идеальным является минимальный уровень альбуминурии или ее отсутствие.
Исходя из генеза микроальбуминурии, можно определить группы препаратов, эффективных в ее ликвидации либо замедлении прогрессирования перехода в протеинурию. То есть, лечение предусматривает снижение кардиоваскулярного риска, маркером которого независимо от имеющейся нозологической формы заболевания является микроальбуминурия. В соответствии с механизмом формирования микроальбуминурии медикаментозные средства можно разделить: 1) на влияющие на эндотелий (ИАПФ, БРА, блокаторы кальциевых каналов, статины); 2) влияющие на процесс гиперфильтрации (ИАПФ, БРА, ингибиторы ренина, симпатолитики и препараты с сопутствующим симпатолитическим действием, например небиволол и эпросартан). Возвращаясь к вышеупомянутому тезису о том, что микроальбуминурия в различные сроки от дебюта заболевания приобретает смешанный генез, наиболее эффективными следует считать ИАПФ, БРА и, возможно, ингибиторы ренина. Эти группы препаратов обладают прямым дозозависимым эффектом. Поэтому после достижения целевого АД при гипертензии или в случае нормотензии последовательное титрование дозы ИАПФ или БРА до максимально переносимой приводит к дальнейшему снижению уровня микроальбуминурии (табл. 2.1). Согласно данным Кокрановской библиотеки (Strippoli GFM, Reviews 2009, Issue 1), по жестким конечным точкам «смертность от всех причин» ИАПФ эффективны только в максимально переносимых дозах.

Однако остается актуальным вопрос, с какого препарата — ИАПФ или БРА при диабетической болезни почек следует начинать терапию? Выбор определяется:
- — доказательной базой в снижении АД, протеинурии и сохранении СКФ;
- — доказательной базой в снижении кардиоваскулярной смертности;
- — печеночным/почечным путем выведения.
При СД 1-го типа KDOQI (2007) рекомендует назначать сначала ИАПФ. Каптоприл, лизиноприл, эналаприл, периндоприл и рамиприл замедляют прогрессирование до макроальбуминурии и уменьшают значения с микроальбуминурии до нормоальбуминурии у пациентов с достигнутым нормальным АД (1а). Напротив, при СД 2-го типа БРА более эффективны, чем другие антигипертензивные препараты, в замедлении прогрессирования диабетической болезни почек, характеризующейся макральбуминурией (KDOQI, 2007). Таким образом, уровень микро-/макроальбуминурии является ведущим в выборе ИАПФ/ БРА при диабетической болезни почек. Вместе с тем следует помнить о предостережениях, полученных по результатам метаанализа, опубликованного в 2007 году в J. Hypertension (рис. 2.6).

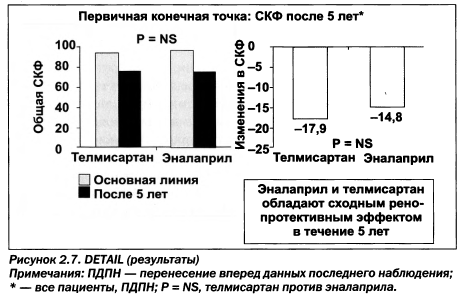
Кроме того, имеются доказательные данные прямого сравнения ИАПФ и БРА при диабетической болезни почек (рис. 2.7).
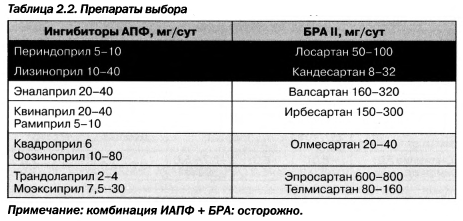
Назначение ИАПФ/БРА следует проводить под контролем уровня калия крови и СКФ. У пациентов с диабетической болезнью почек нередко снижен функциональный почечный резерв, и достижение целевых уровней АД может приводить к электролитным нарушениям, ишемической нефропатии и росту азотистых шлаков. В связи с этим при нормальной СКФ, которую на первой стадии диабетической болезни почек следует оценивать по пробе Реберга — Тареева, чтобы не пропустить гиперфильтрацию, а в последующем по формулам C-G, MDRD, препаратами выбора могут быть любые ИАПФ/БРА с доказательной базой. По мере снижения функции почек предпочтение следует отдавать представителям серого сектора (табл. 2.2), имеющим преимущественно внепочечный путь элиминации, так как они не требуют коррекции дозы. Напротив, для препаратов, имеющих преимущественно почечный путь элиминации (черный сектор), следует уменьшать дозировку, что ведет к снижению терапевтического эффекта.
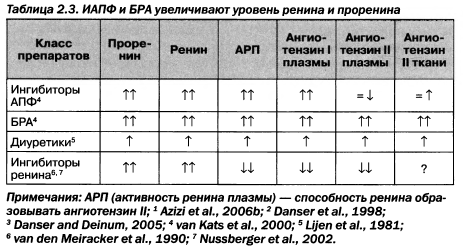
Следует отметить, что назначение ИАПФ/БРА или тиазидных диуретиков повышает уровни ренина плазмы (табл. 2.3).
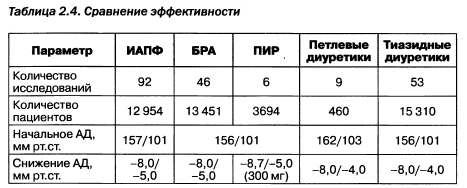
Вместе с тем антигипертензивная эффективность ИАПФ, БРА и ПИР практически одинакова (табл. 2.4).
Накапливаемая по прямым ингибиторам ренина доказательная база (6-летняя программа ASPIRE HIGHER у 35 тыс. пациентов), в том числе при диабетическом поражении почек, свидетельствует о выраженном антигипертензивном и антипротеинурическом эффектах. Складывается впечатление, что ПИР вытеснят БРА во многих клинических ситуациях. Тем не менее клиническая эффективность ИАПФ/БРА очевидна. Возможными путями решения проблемы являются блокирование синтеза ренина ПИР, например, алискиреном 150—300 мг/сут, проведение двойной блокады РААС путем сочетанного назначения ИАПФ + БРА или ИАПФ/БРА + ПИР (или антагониста альдостерона, или симпатолитика) (рис. 2.8). Вопрос о сочетанной терапии ИАПФ и БРА остается дискутабельным (рис. 2.9).

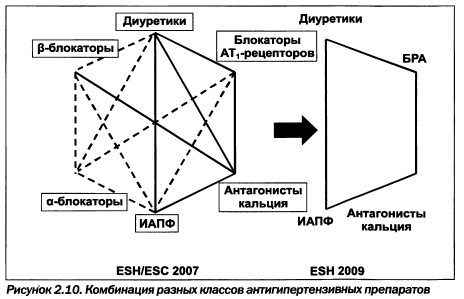
Кроме того, такая комбинация не рассматривается как приоритетная Европейским кардиологическим обществом (2009), а снижение АД может усугублять проявления ишемической болезни почек из-за почечной гипоперфузии, особенно у лиц старшей возрастной группы и пациентов с ишемической болезнью сердца. Поэтому актуальным является использование комбинации ИАПФ (БРА) с препаратами других групп, а именно диуретиками (в первую очередь тиазидоподобными), кальциевыми блокаторами и отдельными р-блокаторами (рис. 2.10).
Руководства не предъявляют строгих требований к диуретикам. Вместе с тем следует помнить, что тиазидные диуретики негативно влияют на холестериновый обмен и стимулируют РААС. Вероятно, предпочтительными препаратами являются тиазидоподобные диуретики индапамид и ксипамид. Следует отметить, что эффективная доза ксипамида возрастает от 10 мг/сутки при нормальной функции почек до 80 мг/сутки при хронической почечной недостаточности. Среди «быстрых» диуретиков, опираясь на исследование TORIC (прямое сравнение фуросемида и торасемида), предпочтение отдается торасемиду, максимальные однократные дозы которого могут достигать 200 мг (приравниваемые к одной таблетке фуросемида 500 мг).
Использование ИАПФ и БРА в сочетании с диуретиками (желательно тиазидоподобными) не всегда позволяет добиться целевого уровня АД и ликвидации/снижения протеинурии. В связи с этим терапия дополняется бета-блокаторами и кальциевыми блокаторами, имеющими доказательную базу в терапии МС и кардиоваскулярных заболеваний, которые являются основной причиной летального исхода при диабетической болезни почек. Среди Р-блокаторов ведущее место принадлежит небивололу и а-Р-блокатору карведилолу (ESC/ESH, 2007). Кальциевые блокаторы с наибольшей селективностью в отношении дистальной части артериальной системы (леркандипин, фелодипин) лидируют благодаря их способности не ухудшать/улучшать внутриклубочковую гемодинамику. Строго говоря, это должны быть кальциевые блокаторы, действующие через низковольтные рецепторы, экспрессирующиеся в норме исключительно в v.efferens. Однако при поражениях почек эти рецепторы экспрессируются и в приносящей артериоле, что, вероятно, и обусловливает эффект недигидропиридиновых кальциевых блокаторов и лерканидипина. Небиволол уменьшает риск развития СД 2-го типа (SENIORS), его эффективная доза может достигать 30 мг/сут. Лерканидипин по своему антипротеинурическому эффекту равен рамиприлу (DIAL) и может успешно использоваться при хронической почечной недостаточности (ZAFRA), его эффективная доза составляет 20 мг/сутки. Эти препараты являются метаболически нейтральными и в определенной мере уменьшают атерогенный эффект.
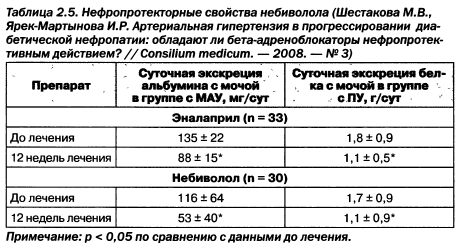
Имеются данные о прямом сравнении ИАПФ и небиволола. Вероятно, подобно различиям ИАПФ/БРА в воздействии на микроальбуминурию, могут формироваться различные эффекты за счет дополнительных эффектов на эндотелий и симпатолитического действия небиволола (табл. 2.5).
Наличие гипертензии при диабетической болезни почек является основанием для назначения ИАПФ и БРА. Однако как поступать при нормо-/гипотензии при диабетической болезни почек или хронической болезни почек? При диабетической болезни почек нормотензия наблюдается в первой стадии поражения почек, сопровождающейся компенсаторной гиперфильтрацией. Очевидно, назначение ИАПФ или БРА позволяет уменьшить гиперфильтрацию в клубочке, но несколько ослабляет компенсаторный клиренс глюкозы, развивающийся при диабете.
При этом с практической точки зрения предпочтительными, как и при хронической почечной недостаточности, являются препараты с внепочечным путем выведения, но уже по иной причине. Антигипертензивный эффект ИАПФ и БРА с внепочечной элиминацией более деликатный, чем, например, у лизиноприла или кандесартана. Поэтому, вероятно, назначение монотерапии моэксиприлом, трандолаприлом, спираприлом, фозиноприлом, эпросартаном, валсартаном или телмисартаном более безопасно для пациента со сниженной функцией почек (табл. 2.6).
Вместе с тем Российские рекомендации (2009) не предполагают снижение дозы эналаприла 20 мг при любой степени хронической почечной недостаточности, а исследование ADVANCE свидетельствует об эффективном и безопасном применении периндоприла в сочетании с индапамидом у пациентов с диабетической болезнью почек.
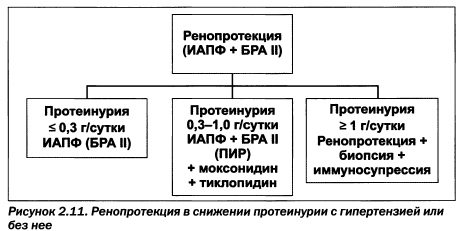
Более понятным в ренопротекторной терапии ИАПФ или БРА является назначение этих препаратов при появлении протеинурии на фоне нормотензии. На сегодняшний день нами используется следующий алгоритм (рис. 2.11).
FDA утверждены дозы для каптоприла, пропранолола, спиронолактона для детей, FDAMA — для амлодипина, беназеприла, эналаприла, лизиноприла, фозиноприла, эплеренона, ирбесартана, лосартана, валсартана, метопролола, ожидается разрешение для алискирена, кандесартана, олмесартана, телмисартана, рамиприла и нитропруссида.
Контроль АД и протеинурии, вероятно, является первостепенным при диабетической болезни почек и хронической болезни почек. Однако не менее важным является контроль гликемии, холестерина и триглицеридов, а также массы тела (окружности талии).
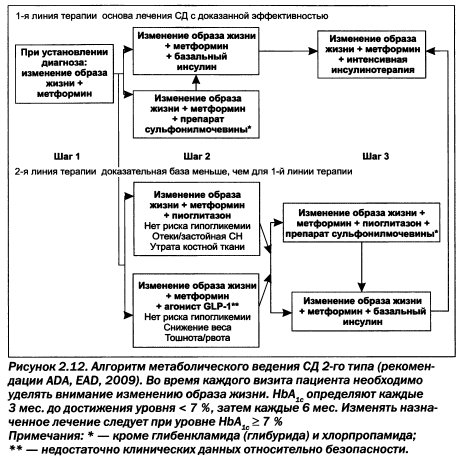
Контроль за уровнем гликемии согласно ADA/EASD (2006—2009) в первую очередь предполагает модификацию стиля жизни с отказом от курения, похудение (индекс массы тела 18,5—24,9 кг/м2, окружность талии для мужчин менее 94 см, для женщин — менее 80 см) и назначение метформина как стартового препарата. При сохранении НЬА1с 7 % и более дальнейшая тактика может базироваться на назначении базального инсулина (наиболее эффективный путь, обязательная опция у беременных и при терминальной ХПН) или применении препаратов сульфонилмочевины (наиболее дешевый) или глитазонов, реже приводящих к гипогликемии. Согласно результатам исследования ADVANCE, сочетанное применение нолипрела форте 5/1,5 мг и диабетона MR (в дозе до 120 мг/сутки) позволило добиться достоверного снижения почечных событий на 33 % (р = 0,005), а также сердечно-сосудистой и общей смертности.
Таким образом, согласно ADVANCE, терапия СД 2-го типа может быть успешно представлена схемой: метформин 2 г/сут + нолипрел форте + диабетон MR (120 мг) + лантус (на ночь однократно). Вновь следует оговориться, что необходим контроль калия и скорости клубочковой фильтрации (группы риска: пожилой возраст, мужской пол, хроническая болезнь почек). Накапливается опыт применения ингаляционного инсулина, ситаглиптина (januvia 100 мг) — единственного на сегодняшний день гипогликемического препарата, разрешенного при хронической почечной недостаточности, а также эксенатида, зарегистрированного в Украине. Многообещающи исследования по применению селективных ингибиторов натрий-глюкозного переносчика (SGLT2), который осуществляет обратный транспорт глюкозы в проксимальных канальцах. Назначение дапаглифлозина приводит к подавлению всасывания профильтровавшейся глюкозы и тем самым способствует снижению гликемии. Современные рекомендации по лечению выглядят следующим образом (рис. 2.12).
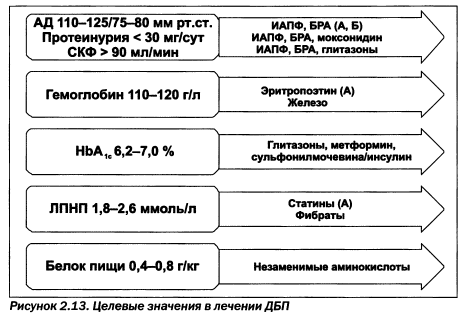
Статины, среди которых розувастатин, аторвастатин, симвастатин и правастатин, назначаются до целевых значений общего холестерина менее 4,5 ммоль/л, современный фенофибрат — трайкор для прицельного снижения триглицеридов (менее 1,7 ммоль/л, рис. 2.13). Антитромбоцитарные препараты (аспирин, клопидогрель, тиклопидин), низкобелковая диета до 0,4 г/кг в сочетании с незаменимыми кетокислотами (кетостерил) или 0,8— 1,0 г/кг без них, эритропоэтинстимулирующие агенты (в том числе пегелированный Р-эритропоэтин — мирцера) с препаратами железа/витаминов группы В (фенюльс, ранферон, глобирон) являются обязательными составляющими комплексной терапии диабетической (и хронической) болезни почек.
Таким образом, следует помнить, что при диабетической болезни почек целесообразно:
- — ежегодное проведение тестов для выявления микроальбуминурии или соотношения альбумин/креатинин или определения скорости клубочковой фильтрации (при ДБП 1-й стадии — по пробе Реберга — Тареева, в дальнейшем по расчетной формуле СКФ) через 5 лет после дебюта СД 1-го типа и с момента установления диагноза СД 2-го типа, а также лицам с АД более 135/80 мм рт.ст. (в особенности после 45 лет или с ИМС более 25 кг/м2);
- — предпочтительное назначение ИАПФ (при непереносимости — БРА) в случае:
а) наличия гаперфильтрации, т.е. СКФ более 120 мл/мин;
б) наличия микроальбуминурии;
в) АД более 130/80 мм рт.ст.; - — до достижения целевого АД комбинировать антигипертензивную терапию в виде ИАПФ (эналаприл, квадроприл, трандолаприл, моэксиприл) или БРА(ирбесартан, эпросартан, олмесартан, телмисартан), а также тиазидоподобного диуретика (индапамид, ксипамид), для стартовой комбинированной терапии при АД > 150/90 мм рт.ст.) — периндоприл + индапамид, Р-блокатора (небиволол, а-Р — карведилол), кальциевого блокатора (леркандипин), прямого ингибитора ренина или моксонидина (физиотенз, моксигама);
- — дополнять терапию статином, антитромбоцитарным препаратом на фоне диеты и модификации стиля жизни до достижения целевых значений. При необходимости использовать аллопуринол. Результаты исследования UKPDS позволили разработать таблицы, определяющие возможную продолжительность жизни пациентов с СД 2-го типа (табл. 2.7). Их использование может быть наглядным примером для пациентов и определенным руководством для врачей.

