Бронхиальная астма
- Бронхиальная астма физического усилия
- Риниты и синуситы
- Гастроэзофагеальный рефлюкс
- Аспириновая астма
Бронхиальная астма (БА) – это заболевание, в основе которого лежат хроническое аллергическое воспаление дыхательных путей и бронхиальная гиперреактивность, что приводит к возникновению приступов обратимой бронхиальной обструкции, обусловленной гиперсекрецией, спазмом гладкой мускулатуры, отеком и клеточной инфильтрацией слизистой бронхов и проявляющейся эпизодами свистящих хрипов, одышки, кашля, чувства стеснения в груди, особенно ночью или ранним утром.
Это одно из самых частых хронических заболеваний легких. В мире ее распространенность составляет от 6 до 20%. По данным официальной статистики показатели заболеваемости этой патологией в Республике Беларусь не превышают 1%. Больше бронхиальная астма распространена среди городского населения с низким уровнем жизни, а также среди лиц, живущих в индустриальных районах и странах с холодным климатом.
Среди детей, страдающих бронхиальной астмой, мальчиков на 30% больше, чем девочек, причем у мальчиков заболевание протекает более тяжело. В подростковом возрасте и у взрослых заболевание чаще встречается у лиц женского пола.
Если бронхиальная астма начинается в раннем детском возрасте, то прогноз, как правило, благоприятный: к периоду полового созревания у 80% пациентов все проявления заболевания исчезают или становятся менее выраженными. Примерно у 20% из них после 45 лет возникает рецидив заболевания. Случаи выздоровления среди взрослых пациентов отмечаются реже. Летальность у детей составляет около 1% (1–1,5:100 000 в популяции), у взрослых – 2–4%.
Патогенез. Ведущую роль в патогенезе бронхиальной астмы играют хроническое аллергическое воспаление и повышенная реактивность бронхов, которые приводят к периодической обратимой бронхиальной обструкции.
Медиаторы, выбрасываемые ТК, влияют на тонус бронхов и сосудов. Гистамин вызывает мгновенный и кратковременный бронхоспазм, тогда как лейкотриены – отсроченный и более длительный. Наряду с отеком и гиперсекрецией большой вклад в бронхиальную обструкцию при хроническом аллергическом воспалении вносит клеточная инфильтрация. Медиаторы стимулируют миграцию вначале эозинофилов и нейтрофилов, а при более длительном течении процесса – моноцитов и лимфоцитов. Этим частично объяснятся резистентность к терапевтическим воздействиям, особенно к тем, которые направлены преимущественно на блокаду эффектов медиаторов ТК. Второй патогенетический фактор – гиперреактивность бронхов, т.е. склонность отвечать бронхоконстрикцией на большое число специфических и неспецифических стимулов. Эти стимулы могут непосредственно влиять на механизмы бронхиальной обструкции, например гистамин или метахолин, или действовать опосредованно, например физические нагрузки, холодный воздух, брадикинин, диоксид серы и др.
Бронхиальная гиперреактивность выявляется при провокационном тесте с метахолином или физической нагрузкой (снижение ОФВ1 более чем на 15%), но слабо коррелирует с клиническими проявлениями болезни, кожными пробами с аллергенами, суточной динамикой пикфлоуметрии. Бронхиальная гиперреактивность часто встречается у людей, никогда не страдавших бронхиальной астмой.
В норме тонус гладких мышц бронхов регулируется преимущественно парасимпатическими волокнами, входящими в состав блуждающего нерва. Применение лекарственных средств, блокирующих проведение возбуждения по парасимпатическим волокнам, приводит к расширению бронхов. Стимуляция этих волокон, напротив, вызывает бронхоспазм. Рецепторы парасимпатической нервной системы активируются гистамином, холодным воздухом, SO 2 . Чувствительность и тонус афферентных холинергических структур повышаются при поражении эпителия и выбросе медиаторов воспаления. Бронхиальная гиперреактивность может быть проявлением синдрома вегетативной дисфункции с преобладанием парасимпатотонуса.
На гладкомышечных клетках бронхов находятся α-, β 1 — и β 2 -адренорецепторы. Преобладают β-адренорецепторы, причем β 2 -адренорецепторов в 3 раза больше, чем β 1 -адре норецепторов. В норме симпатическая нервная система играет незначительную роль в регуляции тонуса гладких мышц бронхов. Гладкая мускулатура бронхов не имеет адренергической иннервации, симпатическое влияние на эти мышцы поддерживается за счет катехоламинов, циркулирующих в крови. Основной их источник – мозговое вещество надпочечников. Снижение функции надпочечников способствует повышению гиперреактивности.
В дополнение к парасимпатическому звену вегетативной нервной системы за повышение тонуса бронхов отвечает NANC-механизм (неадренергический, нехолинергический), опосредованный передачей возбуждения по так называемым классическим автономным нервам. Ингибиторами NANC являются вазоактивный интерстициальный пептид (VIP) и оксид азота (NO). Как VIP, так и NO способны предупредить развитие бронхоспазма, индуцируемого фармакологическими препаратами. Однако VIP быстро разрушается триптазой, высвобождаемой при дегрануляции ТК, а NO – свободными радикалами кислорода, выделяемыми нейтрофилами. Подавление ингибиторов NANC наблюдается при хроническом аллергическом воспалении и обусловливает усиление бронхиальной гиперреактивности. Стимуляторами NANC являются многочисленные нейропептиды, например вещество P и нейрокинин, которые вызывают сужение бронхов, отек слизистой и увеличение секреции слизи. В норме их разрушает нейтральная эндопептидаза, вырабатываемая бронхиальным эпителием. Слущивание эпителия, наблюдаемое при хроническом аллергическом воспалении, способствует развитию гиперреактивности. Правильная оценка соотношения вкладов гиперчувствительности и гиперреактивности в патогенез заболевания (рис. 5) у конкретного пациента – один из ключевых моментов при разработке тактики лечебно-профилактических мероприятий.
Острые респираторные заболевания очень часто ассоциированы с приступами бронхиальной астмы. У 40% астматиков выявляются антигены респираторно-синцитиального вируса, парагриппа и гриппа, риновируса и аденовируса. Предполагается, что вирусы снижают чувствительность β-адренорецепторов, повреждают эпителий и таким образом повышают реактивность бронхов, а также способствуют переключению иммунного ответа на Т H 2-вариант. До 50% детей, перенесших на первом году жизни бронхиолит, вызванный респираторно-синцитиальным вирусом, заболевают БА в течение последующих 8 лет. Таким образом, атопия и гиперреактивность бронхов тесно переплетаются в патогенезе бронхиальной астмы, взаимно стимулируя и поддерживая друг друга.
Обструкция дыхательных путей – основной, наиболее характерный признак бронхиальной астмы. Патологические изменения, приводящие к сужению просвета бронхов, затрагивают слизистую оболочку, подслизистый слой и мышечную оболочку бронхиального дерева.
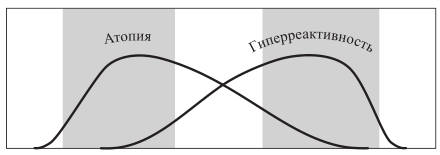
Рис. 5. Атопия и гиперреактивность бронхов в патогенезе бронхиальной астмы
Патологический процесс распространяется от трахеи и крупных бронхов к терминальным бронхиолам. К нарушению бронхиальной проводимости приводит спазм гладких мышц бронхиальной стенки, образование слизистых пробок и воспаление слизистой бронхов.
Обструкция бронхов во время приступа бронхиальной астмы приводит к уменьшению форсированной жизненной емкости легких (ФЖЕЛ), особенно в первую секунду (ОФВ1), и увеличению остаточного объема (ОО). Обструкция бронхов во время приступа неравномерна, поэтому одни участки легких вентилируются лучше, другие – хуже. Перфузия плохо вентилируемых участков снижается. Равновесие между вентиляцией и перфузией нарушается, что приводит к снижению paO 2 (в артериальной крови). В легких случаях это может быть единственным изменением газового состава крови. Уровень paCO 2 зависит от вентиляции альвеол. При легких и среднетяжелых приступах бронхиальной астмы возникает гипервентиляция, которая приводит к уменьшению paCO 2 и дыхательному алкалозу.
Тяжелые приступы бронхиальной астмы, при которых ОФВ1 составляет менее 15–20% нормального объема, сопровождаются снижением pH. Это обусловлено накоплением лактата и метаболическим ацидозом (BE менее – 2 мэкв/л), которому сопутствует повышение p a CO 2 – респираторный ацидоз, развивающийся вследствие гиповентиляции. Перерастяжение легких и снижение парциального давления кислорода в альвеолах вызывают сужение капилляров альвеол и повышение давления в легочной артерии.
Классификация. В МКБ-10 предлагается следующая классификация бронхиальной астмы.
J45. Астма.
J45.0. Астма с преобладанием аллергического компонента.
Аллергический:
- бронхит БДУ;
- ринит с астмой.
Атопическая астма, экзогенная аллергическая астма, сенная лихорадка с астмой.
J45.1. Неаллергическая астма.
Идиосинкразическая астма, эндогенная неаллергическая астма.
J45.8. Смешанная астма.
Сочетание состояний, указанных в рубриках J45.0 и J45.1.
J45.9. Астма неуточненная.
Астматический бронхит БДУ, поздно начавшаяся астма.
J46. Астматический статус [status asthmaticus].
Острая тяжелая астма.
Астма с преобладанием аллергического компонента возникает практически в 80% случаев у лиц младше 20 лет и приблизительно в 40–50% случаев у взрослых. Кожные и провокационные пробы с аллергенами высоко информативны. Неаллергическая астма обусловлена главным образом бронхиальной гиперреактивностью. Провоцируют бронхообструкцию не аллергены, а инфекция, физическое или эмоциональное перенапряжение, резкие смены температуры, влажности воздуха и т.д. Смешанная форма заболевания сочетает в себе признаки обоих указанных выше вариантов бронхиальной астмы.
В связи с изменением аллергической номенклатуры эксперты EAACI (Европейская академия аллергологии и клинической иммунологии) предложили несколько изменить (в сторону упрощения) и классификацию бронхиальной астмы, оставив только аллергическую (опосредованную иммунными механизмами) и неаллергическую астму, выделив в аллергической астме IgE-опосредованный и неиммуноглобулин E-опосредованный варианты.
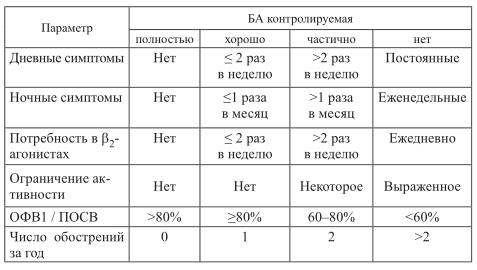
Второй классификационный критерий – степень контроля. Он устанавливается на основании таких показателей, как частота приступов, наличие ночных приступов, потребность в β 2 -агонистах, выраженность нарушения функции легких (табл. 20).
Таблица 20. Степени контроля астмы
Диагностика. Оценка аллергического статуса помогает определить факторы риска, что важно для составления профилактических рекомендаций и необходимо для проведения иммунотерапии аллергенами. Правильно собранный аллергологический анамнез позволяет выяснить не только характер заболевания, но и предположить его этиологию (наиболее вероятный аллерген или группу аллергенов, ответственных за развитие бронхиальной астмы в каждом конкретном случае).
При сборе аллергологического анамнеза особое внимание следует обращать:
- на семейную предрасположенность к аллергическим заболеваниям и аллергическим реакциям;
- характер работы пациента – производственные вредности, работа с химическими веществами, на пищевом производстве, в парфюмерной промышленности и т.д.;
- связь ухудшения состояния пациента с употреблением определенных продуктов, приемом медикаментов, выездом в лес (поле), контактами с книгами, животными (птицами, рыбами), воздействием тепла или холода, пребыванием в сыром помещении и т.д.;
- сезонность обострений;
- жилищно-бытовые условия (старое жилье, скученность проживания, наличие в помещении ковров, мягкой мебели, книг, животных, рыб, птиц, старых постельных принадлежностей, цветов и др.);
- улучшение состояния пациента вне дома, при госпитализации или перемене места жительства;
- наличие других аллергических симптомов (зуд век, слезотечение, чихание, заложенность носа, высыпания на коже);
- сопутствующие заболевания (органов пищеварения, почек, ЛОР органов, нервной системы);
- наличие в анамнезе указаний на кожные аллергические проявления в первые годы жизни (упорные опрелости, гнейс, гиперемия, шелушение, экссудация, сухость кожи, экскориации) и их причины (прививки, переход на смешанное вскармливание, введение прикорма и т.д.);
- частоту ОРВИ (сколько раз в год).
При грамотно собранном анамнезе можно установить связь появления симптомов с определенными аллергенами. Для пыльцевой аллергии характерны сочетание БА с ринитом и конъюнктивитом, сезонность обострений (появление признаков болезни в период цветения растений), метеозависимость (ухудшение самочувствия пациентов в сухую ветреную погоду, когда создаются наилучшие условия для распространения пыльцы), перекрестная пищевая сенсибилизация (примерно в 40%) и непереносимость некоторых фитопрепаратов.
Для бытовой аллергии типичны уменьшение или исчезновение симптомов болезни вне дома, обострения в сырое время года (осенью, зимой, ранней весной), усиление симптомов в первую половину ночи, появление их при уборке квартиры, выбивании ковров и т.п.
Для аллергии на шерсть животных характерны возникновение симптомов при контакте с животными и ношении одежды из шерсти и меха, непереносимость препаратов, содержащих белки животных (гетерологичные сыворотки, иммуноглобулины и т.д.).
При грибковой аллергии отмечаются непереносимость продуктов, содержащих дрожжи (пиво, квас, сухие вина, кисломолочные продукты), ухудшение состояния во влажную погоду, при посещении сырых, плохо проветриваемых помещений, ухудшение состояния весной, летом и в начале осени, наличие очагов грибковой инфекции.
Наиболее диагностически значимыми проявлениями бронхиальной астмы являются обратимые приступы свистящих хрипов, мучительный кашель по ночам, свистящие хрипы или кашель, возникающие после физической нагрузки, чувство стеснения в груди или кашель в результате воздействия аэроаллергенов или поллютантов. Также имеют определенную диагностическую значимость такие факты, как указание в анамнезе на то, что острый ринофарингит у пациента часто осложняется бронхитом или продолжается более 10 дней, отмечается положительный эффект после проведения антиастматической терапии.
Особое внимание следует уделять диагностике бронхиальной астмы у детей с повторяющимися эпизодами кашля и у пожилых людей с профессиональными факторами риска, которые способны вызывать БА. Оценка функции легких значительно повышает достоверность диагноза. Наиболее информативны при постановке диагноза бронхиальной астмы (у пациентов старше 5 лет): объем форсированного выдоха в первую секунду (ОФВ1), форсированная жизненная емкость легких, пиковая скорость выдоха (ПСВ). Бронхиальная обструкция проявляется снижением этих показателей и в первую очередь снижением ОФВ1. Увеличение ОФВ1 после применения бронходилататоров более чем на 15% так же свидетельствует об обратимости бронхообструкции. Для контроля состояния пациентов на амбулаторном этапе лечения достаточно с помощью пикфлоуметра измерять суточную вариабельность ПСВ. Чем выше вариабельность ПСВ, тем хуже контролируется астма.
В общем анализе крови при бронхиальной астме может определяться умеренная эозинофилия. Однако изменения содержания эозинофилов в крови, как и изменения других показателей в общем и биохимическом анализе крови, не являются строго специфичными для бронхиальной астмы.
Важно для дифференциальной диагностики исследование бронхиального секрета (бронхоальвеолярной лаважной жидкости). Чем выше роль аллергического компонента, тем выше уровень эозинофилов в секрете. Для правильной трактовки результатов рекомендуется сравнивать лейкоцитарную формулу бронхиального секрета с лейкоцитарной формулой крови (их образцы должны быть получены с минимальным временным разрывом). Если процент эозинофилов в секрете выше, чем в крови, это с большой вероятностью свидетельствуют о хроническом аллергическом процессе, если повышены нейтрофилы (по сравнению с показателями крови), это является признаком инфекционного воспаления.
При аллергической бронхиальной астме в период обострения уровень общего IgE в сыворотке обычно повышен. Это особенно характерно при сочетании БА с атопическим дерматитом или ринитом. Для уточнения этиологических факторов и определения тактики лечения аллергической БА проводят кожные скарификационные пробы или prick-тест (микроукол в пределах эпидермиса). Альтернативным способом выявления причинно-значимого аллергена является определение уровня специфических IgE в сыворотке крови, например с помощью иммуноферментного анализа. Определение уровня специфических IgE имеет следующие преимущества по сравнению с кожными пробами:
- это исследование безопасно для пациента;
- может выполняться в период обострения заболевания;
- результаты не зависят от кожной реактивности.
К недостаткам этого метода исследования относятся:
- ограниченный набор аллергенов, используемых для выявления антител;
- более низкая чувствительность, чем у внутрикожных проб;
- большие затраты времени;
- высокая стоимость;
- возможность ложноотрицательных результатов при длительном отсутствии контакта с причинно-значимым аллергеном.
Определение уровня специфических IgE показано при сочетании бронхиальной астмы с диффузным атопическим дерматитом, пониженной или повышенной кожной реактивностью, анафилаксией в анамнезе, при приеме H 1 -гистаминоблокаторов – с невозможностью прекращения медикаментозной терапии заболевания. Для выявления гиперреактивности бронхов обычно используют провокационные пробы. Ингаляция M-холиностимулятора метахолина вызывает бронхоспазм у большей части пациентов с бронхиальной астмой и у 10% здоровых лиц. У последних он может быть обусловлен недавно перенесенной инфекцией верхних дыхательных путей (в течение последних 6 недель), недавней вакцинацией против гриппа, контактом с веществами, загрязняющими воздух. Другие провокационные пробы включают физическую нагрузку (6–10 мин велоэргометрии или бега на тредмиле с нагрузкой 1,5 Вт/кг), ингаляцию гипотонического раствора натрия хлорида.
Провокационные тесты с ингаляцией аллергенов проводятся очень редко: если на основании анамнеза не удается выявить связь между приступами астмы и воздействием аллергенов, обнаруживаемых с помощью кожных проб или радиоаллергосорбентного теста. Исследование газов артериальной крови показано при выраженной одышке, снижении эффективности бронходилататоров, значительных тахипноэ и тахикардии. При выраженном снижении p a O 2 (< 60 мм рт. ст.) или повышении p a CO 2 показана ингаляция кислорода.
Общие принципы лечения. Программа ведения пациентов включает их обучение, устранение воздействия причинных факторов, разработку индивидуальных планов купирования обострений и медикаментозной терапии для длительного лечения пациентов вне обострений, мониторирование тяжести бронхиальной астмы путем записи симптомов и с помощью инструментального исследования функции легких (пикфлуометрия и спирография). Обучение пациента подразумевает установление партнерства между ним и медицинским работником для постоянного обновления и проверки знаний. Цель – научить пациента самостоятельно контролировать свое состояние под постоянным наблюдением медицинского работника. Основной формой очного обучения в Республике Беларусь является «школа астматика».
Элиминация аллергена – чрезвычайно важный компонент лечения бронхиальной астмы, приводящий к снижению тяжесть болезни, длительности госпитализации и потребности в фармакологических препаратах. Лекарственные препараты, используемые для лечения бронхиальной астмы, подразделяют на базисные и симптоматические.
Базисные препараты принимают ежедневно, длительно для достижения и сохранения контроля над бронхиальной астмой; в их состав входят ингаляционные ГКС, системные ГКС, теофиллин замедленного высвобождения, ингаляционные β 2 -агонисты длительного действия, антилейкотриеновые препараты, а также антагонисты IgE.
Симптоматические препараты, или препараты неотложной помощи, используют для устранения бронхоспазма и облегчения сопутствующих симптомов (свистящих хрипов, чувства стеснения в грудной клетке и кашля). Они включают β 2 -агонисты, метилксантины короткого действия и антихолинергические препараты. Препараты для лечения бронхиальной астмы могут вводиться ингаляционно, перорально и парентерально (подкожно, внутримышечно и внутривенно). Основное преимущество ингаляционного способа введения – более эффективное создание высоких концентраций препарата в дыхательных путях и устранение или сведение к минимуму нежелательных системных эффектов.
Ингаляционные ГКС (будесонид, флютикозон, циклесонид) в настоящее время являются самыми эффективными противовоспалительными препаратами для лечения бронхиальной астмы. Установлено, что при бронхиальной астме прием ингаляционных ГКС в течение 1 месяца или более достоверно уменьшает воспалительные изменения в дыхательных путях.
Системные ГКС обычно используются для контроля тяжелой бронхиальной астмы, однако их применение ограничено возможными нежелательными эффектами. Следует помнить, что нежелательные системные эффекты при пероральном приеме ГКС бывают реже, чем при парентеральном введении. Из метилксантинов для лечения бронхиальной астмы рекомендуется использовать теофиллин замедленного высвобождения и аминофиллин. Теофиллин – бронхолитик, обладающий также противовоспалительным эффектом. Бронхорасширяющее действие теофиллина может быть обусловлено подавлением активности фосфодиэстеразы и наблюдается при высоких концентрациях препарата в крови (более 10 мкг/мл), в то время как его противовоспалительный эффект реализуется через неизвестный механизм и возникает при меньших концентрациях (5–10 мкг/мл).
Длительный прием теофиллина замедленного высвобождения эффективно контролирует симптомы бронхиальной астмы и улучшает функцию внешнего дыхания. Он обладает большой продолжительностью действия, и поэтому его целесообразно применять для контроля ночных симптомов, которые сохраняются, несмотря на лечение другими препаратами. Теофиллин используют также в качестве дополнительного бронхолитика у пациентов с тяжелой БА. При этом он, как правило, менее эффективен, чем ингаляционные β 2 -агонисты длительного действия, однако представляет собой более дешевую альтернативу.
Ингаляционные β 2 -агонисты длительного действия (сальмотерол, формотерол) расслабляют гладкую мускулатуру бронхов, усиливают мукоцилиарный клиренс, уменьшают сосудистую проницаемость и могут подавлять высвобождение медиаторов из ТК и базофилов.
Назначают ингаляционные β 2 -агонисты длительного действия, когда стандартные начальные дозы ингаляционных ГКС не позволяют достичь контроля бронхиальной астмы, это дает лучший эффект, чем просто увеличение дозы ингаляционных ГКС в 2 раза. Прием β 2 -агонистов всегда должен сочетаться с приемом ингаляционных ГКС. Для этого более удобно использовать ингаляторы с фиксированными комбинациями препаратов (флютиказона пропионат и сальметерол, будесонид и формотерол). Антилейкотриеновые препараты включают антагонисты рецепторов к цистеинил-лейкотриену (цисЛТ1) (монтелукаст, зафирлукаст) и ингибитор 5-липооксигеназы (зилеутон). Ингибиторы 5-липооксигеназы подавляют синтез всех лейкотриенов. Антагонисты рецепторов лейкотриена блокируют цисЛТ1-рецепторы гладкой мускулатуры бронхов и других клеток и тем самым угнетают эффекты лейкотриенов, которые высвобождаются из тучных клеток. Эти механизмы уменьшают бронхоконстрикцию, индуцированную аллергенами, физической нагрузкой и диоксидом серы. Клинические исследования показали, что антилейкотриеновые средства обладают слабым и нестойким бронхорасширяющим эффектом, уменьшают выраженность симптомов, улучшают функцию внешнего дыхания и уменьшают число обострений бронхиальной астмы. Их эффективность ниже, чем ингаляционных ГКС. В качестве дополнительного компонента терапии эти средства менее эффективны, чем ингаляционные β 2 -агонисты длительного действия. Наиболее хороший эффект антилейкотриеновые средства дают при аспириновой астме.
Для снижения потребности в пероральных ГКС в случае их плохой переносимости применяют иммунодепрессанты (циклоспорин, метотрексат) и некоторые макролиды. Эти лекарства следует назначать только отдельным пациентам под наблюдением пульмонолога, поскольку их возможный эффект по снижению дозы стероидов может не оправдать риска нежелательных действий.
Ингаляционные β 2 -агонисты быстрого действия (симпатомиметики) оказывают бронхорасширяющий эффект и обеспечивают быстрое купирование симптомов бронхиальной астмы. К ним относятся сальбутамол (альбутерол), тербуталин, фенотерол. Следует помнить, что потребность в ежедневном, применении ингаляционных β 2 -агонистов быстрого действия является тревожным симптомом, свидетельствующим об ухудшении течения БА и о необходимости назначить или усилить постоянную противовоспалительную терапию. Аналогичным образом отсутствие быстрого и стойкого ответа на применение β 2 -агониста при обострении БА требует повышенного внимания и может указывать на необходимость короткого курса пероральных ГКС.
Метилксантины короткого действия (эуфиллин, теофиллин короткого действия) можно применять для купирования симптомов, хотя их эффект проявляется существенно позже, чем β 2 -агонистов быстрого действия.
Ингаляционные антихолинергические препараты (ипратропиума бромид, окситропиума бромид) – это бронхолитики, которые блокируют эффект ацетилхолина, высвобождающегося из холинергических нервных окончаний в дыхательных путях. После ингаляции эти препараты вызывают расширение бронхов путем снижения собственного холинергического тонуса ветвей блуждающего нерва в дыхательных путях. Они также блокируют рефлекторную бронхоконстрикцию, вызванную вдыханием раздражающих веществ.
Важнейшим компонентом любого индивидуального плана лечения является мониторирование степени контролируемости бронхиальной астмы. Схематически ступенчатый подход к терапии бронхиальной астмы представлен в табл. 21.
В период обострения бронхиальной астмы рекомендуется начинать лечение со 2-й ступени, при выраженной клинической симптоматике – с 3-й. В качестве скорой помощи на любой ступени назначаются ингаляционные β 2 -агонисты короткого действия. Их принимают только для купирования приступа (на фоне базисной терапии).
Как только удается удержать контроль за БА в течение трех месяцев, можно обсуждать вопрос о переходе на ступень вниз. Если в течение месяца состояние не улучшается и полный контроль не достигается, следует подняться на ступень вверх.
Таблица 21. Принципы ступенчатой терапии бронхиальной астмы

Во многих странах для лечения аллергических заболеваний применяется иммунотерапия аллергенами (ИТА) с использованием экстрактов аллергенов. У пациентов с бронхиальной астмой ИТА способствует снижению выраженности симптомов и потребности в лекарственных препаратах, а также улучшению специфической и неспецифической гиперреактивности дыхательных путей. Тем не менее, учитывая относительно умеренную эффективность ИТА при бронхиальной астме, ее рекомендуется назначать в случаях, когда фармакотерапия, включая ингаляционные ГКС, не позволила достичь контроля бронхиальной астмы.
Лечение бронхиальной астмы гистаглобулином в настоящее время используется достаточно редко. Показания к его назначению сильно сужены в связи с тем, что гистаглобулин является препаратом крови. Оказывает положительный эффект у некоторых пациентов с бронхиальной астмой. Проводится в период ремиссии. Эффект, вероятно, связан со стимуляцией гистаминпектической ферментной системы.
Хотя у некоторых пациентов альтернативные и народные методы лечения весьма популярны, они пока недостаточно изучены, а их положительный эффект при лечении бронхиальной астмы большей частью не доказан. К таким методам относятся акупунктура, гомеопатия, траволечение, спелеотерапия, гипноз и внушение, натуропатия и поведенческая терапия. До проведения адекватно контролируемых исследований никаких выводов об их эффективности делать нельзя.
Бронхиальная астма физического усилия
Для большинства пациентов с бронхиальной астмой физическая нагрузка – важный фактор, провоцирующий обострения. Даже 10–15-минутная физическая нагрузка может вызывать бронхоспазм. Чем тяжелее БА, тем более выраженный бронхоспазм вызывает физическая нагрузка, но лишь у небольшой части пациентов возникновение приступа бронхиальной обструкции провоцируется не контактом с аллергеном, а только физической нагрузкой.
Состояние, при котором бронхоспазм, возникший после физической нагрузки, самостоятельно разрешается спустя 30–45 мин (редко сохраняется более 1 ч) носит название бронхиальной астмы физического усилия.
Частота и выраженность приступов бронхиальной астмы, вызванных физической нагрузкой, зависят от ее характера. Чаще всего бронхоспазм возникает при быстром беге, реже – при ходьбе и езде на велосипеде. Плавание обычно не вызывает бронхоспазма. Бронхиальная астма физического усилия может возникнуть в любых климатических условиях, но ее вероятность значительно выше при вдыхании сухого холодного воздуха.
Бронхиальная астма физического усилия – это одно из проявлений гиперреактивности дыхательных путей, а не особая форма бронхиальной астмы. В механизме бронхиальной обструкции основную роль, вероятно, играет охлаждение и пересушивание слизистой оболочки дыхательных путей. Следует подчеркнуть, что морфологические изменения в слизистой респираторного тракта при аллергической астме и астме физического усилия идентичны, поэтому общие принципы лечения этих заболеваний одинаковы. Бронхиальная астма физического усилия иногда служит индикатором плохого контроля бронхиальной астмы, и, как правило, адекватная противовоспалительная терапия приводит к уменьшению ее симптомов.
В редких случаях, когда, несмотря на проводимую в полном объеме терапию, сохраняется бронхиальная астма физического усилия и когда эта форма – единственное проявление болезни, наиболее эффективным способом профилактики обострения служит ингаляция β 2 -агониста короткого действия за 15–20 мин до физической нагрузки. Многие другие препараты (кромогликат натрия, недокромил, антихолинергические препараты, теофиллин, ингаляционные ГКС, β 2 -агонисты длительного действия, антигистаминные и антилейкотриеновые препараты) также бывают эффективны при БА физического усилия. Тренировки и поддержание комфортного температурного режима и влажности окружающей среды снижают частоту и тяжесть БА физического усилия.
Поскольку эффективность лечения бронхиальной астмы физического усилия обычно высокая, пациентам не следует избегать физической активности. Напротив, цель лечения бронхиальной астмы заключается в том, чтобы большинство из них могло безбоязненно участвовать в любом виде физической активности. Более того, физическая активность должна быть частью схемы лечения бронхиальной астмы. Занятия физкультурой снижают уровень вентиляции, необходимый для поддержания определенного уровня активности. Тяжесть бронхиальной астмы физического усилия зависит от вентиляции, поэтому у хорошо тренированных пациентов симптомы БА возникают только при более тяжелых нагрузках, чем во время обычных тренировок.
Кроме того, занятия физкультурой улучшают состояние сердечно-сосудистой и легочной систем, поэтому важно рекомендовать пациентам заниматься спортом и не избегать физических нагрузок.
Риниты и синуситы
У большинства пациентов с бронхиальной астмой (75% с аллергической БА и свыше 80% с БА неаллергического генеза) имеются симптомы сезонного или круглогодичного аллергического ринита. Как БА, так и ринит считаются воспалительными заболеваниями дыхательных путей. Однако между ними существуют некоторые различия относительно механизмов, клинических признаков и подхода к терапии. При рините назальная обструкция вызвана во многом переполнением кровеносных сосудов, в то время как при бронхиальной астме обратимая обструкция дыхательных путей обусловлена, главным образом, сокращением гладкой мускулатуры. При бронхиальной астме воспаление слизистой дыхательных путей сопровождается слущиванием эпителия, утолщением ретикулярного слоя субэпителиальной базальной мембраны и гипертрофией гладкой мускулатуры дыхательных путей. При круглогодичном рините эпителий обычно не слущивается.
Лечение ринита может уменьшить симптомы бронхиальной астмы. При обоих состояниях эффективны противовоспалительные препараты, включая ГКС, кромоны, антилейкотриеновые препараты и антихолинергические средства. Однако существуют различия в лечении двух заболеваний: некоторые препараты избирательно эффективны при рините (например, α-агонисты, Н 1 -антагонисты), а другие – при бронхиальной астме (например, β 2 -агонисты).
Синусит – это осложнение инфекционных заболеваний верхних отделов дыхательных путей, аллергического ринита, полипоза носа и других форм назальной обструкции. Как острый, так и хронический синусит могут провоцировать приступы бронхиальной астмы.
Диагностика синусита требует проведения рентгенографии или компьютерной томографии; клинические признаки синусита часто слишком стерты, чтобы поставить диагноз. Антибиотикотерапия синуситов может на какой-то период сопровождаться снижением тяжести бронхиальной астмы. Вероятность эффективности такой терапии будет выше, если антибиотики назначают не менее чем на 10 дней. Лечение должно также включать препараты, уменьшающие застойные явления в носовых ходах (деконгестанты или ГКС интраназально). Каким бы важным ни было такое лечение, оно остается лишь дополнением к основной противоастматической терапии.
Гастроэзофагеальный рефлюкс
Связь усиления симптомов бронхиальной астмы (особенно ночью) с гастроэзофагеальным рефлюксом остается предметом дискуссии, хотя среди пациентов с бронхиальной астмой это состояние встречается примерно в 3 раза чаще, чем в популяции. В большинстве случаев также выявляется грыжа пищеводного отверстия диафрагмы. Более того, использование метилксантинов может повысить частоту симптомов за счет развития гипотонии эзофагогастрального сфинктера. Диагноз ставится с помощью одновременного мониторирования рН в пищеводе и показателей функции внешнего дыхания.
Для уменьшения симптомов рефлюкса необходимо назначать консервативное лечение: частые приемы пищи маленькими порциями, отказ от приема пищи или питья между основными приемами пищи, и особенно на ночь, отказ от жирной пищи, алкоголя, теофиллина и пероральных β 2 -агонистов, применение Н 2 -гистаминоблокаторов или ингибиторов протонной помпы, а также сон с приподнятым головным концом кровати. Для пациентов с тяжелыми симптомами и подтвержденным эзофагитом, не поддающимся консервативному лечению, в резерве остаются хирургические методы лечения, однако они не всегда эффективны.
Аспириновая астма
У 4–28% взрослых пациентов с бронхиальной астмой (редко у детей) ее обострения вызывают аспирин и другие НПВС. Первые симптомы, как правило, появляются в 30–40 лет. В типичных случаях у пациентов возникает вазомоторный ринит и полипоз носа. Бронхиальная астма и непереносимость аспирина развиваются на последующих стадиях заболевания. Сама по себе картина непереносимости очень своеобразна: в пределах 1 ч после приема аспирина возникает острый приступ бронхиальной астмы, часто сопровождающийся ринореей, раздражением конъюнктивы с появлением скарлатиноподобной сыпи на коже головы и шеи. Эти реакции опасны, даже однократный прием любого ингибитора циклооксигеназы может вызвать тяжелый бронхоспазм, шок, потерю сознания и остановку дыхания.
В дыхательных путях пациентов с аспириновой астмой обнаруживается персистирующее воспаление и более выраженная эозинофилия, чем у лиц с бронхиальной астмой, переносящих аспирин. При аспириновой астме в дыхательных путях увеличена продукция ИЛ-5, лейкотриенов и экспрессия лейкотриен-С4синтетазы (LТС4-синтетаза). Этот феномен частично объясняется генетическим полиморфизмом промотора гена LТС4синтетазы. Вариант, создающий предрасположенность к аспиринчувствительной астме, обнаруживается у 70% пациентов. Однако до конца патогенез аспириновой астмы остается неясным.
Частота и тяжесть приступов бронхиальной астмы зависят от вида НПВС и его дозы, а также от индивидуальной чувствительности пациента. Приступ могут вызвать индометацин, мефенамовая кислота, феназон, аминофеназон, пищевой краситель тартразин, а также некоторые продукты питания, содержащие аспириноподобные вещества. В первую очередь это малина, клубника, виноград, сливы и т.п. Обычно не противопоказаны неацетилированные салицилаты и парацетамол.
Лабораторных тестов для верификации диагноза аспириновой бронхиальной астмы не существует, с достоверностью он может быть установлен лишь после пробы с аспирином. Эту пробу выполняют у пациентов с бронхиальной астмой в стадии ремиссии и при показателях ОФВ1 выше 70% от должных или наилучших индивидуальных значений. Пероральную пробу проводить опасно, более безопасной является ингаляционная проба с лизинаспирином. Интраназальная проба менее чувствительна, но более безопасна, чем ингаляционная, поэтому ее можно использовать в качестве первоначального теста. Пробу проводят утром, в присутствии квалифицированного врача и при наличии реанимационной аппаратуры. Ее считают положительной при снижении ОФВ1 или ПСВ не менее чем на 15%, с появлением симптомов бронхиальной обструкции, раздражения со стороны носа и глаз. В отсутствие этих симптомов реакция считается положительной, если ОФВ1 или ПСВ снижается более чем на 20%.
Однажды развившись, непереносимость аспирина или НПВС сохраняется на всю жизнь. Пациентам с аспириновой астмой нельзя принимать аспирин, продукты, его содержащие, другие анальгетики, которые ингибируют циклооксигеназу, а также гидрокортизона гемисукцинат. Однако эти мероприятия не предотвращают прогрессирования воспалительного процесса. Помощь при приступах бронхиальной астмы проводят по стандартной схеме. Однако приступы при аспириновой бронхиальной астме обычно тяжелые и плохо снимаются адреномиметиками, часто обструкция купируется только при назначении ГКС, а в качестве дополнительного средства для контроля рассматриваемого заболевания назначают антилейкотриеновые препараты.
Пациентам с аспириновой бронхиальной астмой, которым НПВС необходимы для лечения других заболеваний, можно проводить десенситизацию, после которой ежедневный прием высоких доз аспирина снижает симптомы воспалительного процесса в слизистой (особенно в полости носа).
