БИОСИНТЕЗ ДНК, РНК И БЕЛКА
БИОСИНТЕЗ ДНК
Репликация — процесс удвоения ДНК (синтез ДНК на матрице ДНК).
Принципы репликации:
1) комплементарность;
2) антипараллельность;
3) однонаправленность;
4) потребность в праймере (затравке);
5) прерывистость;
6) полуконсервативность.
Первые 3 принципа можно сформулировать одной фразой: синтез каждой дочерней цепи ДНК идет комплементарно и антипараллельно матричной цепи и всегда в направлении 5/ 3/.
Ферменты и белки, участвующие в репликации (их > 40), объединены в единый комплекс — реплисому.
Хеликаза — раскручивает двойную спираль ДНК в репликационной вилке.
Топоизомераза — снимает напряжение, возникающее в репликационной вилке, и предотвращает обратное скручивание цепей.
Праймаза — синтезирует праймеры. Праймаза является РНК-полимеразой, поэтому образующиеся праймеры представляют собой олигорибонуклеотиды.
ДНК-полимераза — главный фермент процесса. Компоненты, необходимые для её работы: матрица, затравочный олигонуклеотид (праймер), субстраты (активированные нуклеотиды — дАТФ, дГТФ, дЦТФ, дТТФ), ионы магния. ДНК-полимераза катализирует реакцию:

Для образования фосфодиэфирной связи используется энергия макроэргического субстрата. Большинство ДНК-полимераз обладают способностью исправлять ошибки, допущенные при синтезе, путем отщепления неправильно присоединенного нуклеотида и замены его на нужный.
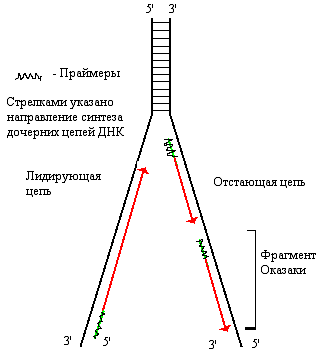
Поскольку цепи ДНК антипараллельны, а синтез идет только от 5/-конца к 3/-концу, одна из дочерних цепей синтезируется прерывисто, образуются фрагменты Оказаки. Впоследствии праймеры (участки РНК) из дочерней цепи удаляются, на их месте достраивается ДНК.
ДНК-лигаза — сшивает фрагменты, образующиеся после удаления праймеров и достройки ДНК.
После окончания репликации ДНК подвергается метилированию (защита от нуклеаз).
У прокариот есть три ДНК-полимеразы — ДНК-полимераза III (непосредственно ведет репликацию), ДНК-полимераза II (участвует в репарации), ДНК-полимераза I (отвечает за удаление праймеров и достройку на их месте ДНК).
У эукариот одновременно с репликацией идет синтез гистонов. Ферменты: ДНК-полимераза α (синтезирует отстающую цепь), β (репаративная), γ (митохондриальная), δ (синтезирует лидирующую цепь), ε (функция точно не установлена). На концах линейных хромосом эукариот имеются теломеры (неинформативные повторяющиеся последовательности нуклеотидов). В соматических клетках с каждым актом репликации теломеры укорачиваются из-за невозможности достроить ДНК на месте 5/-праймера. Это своеобразные «молекулярные часы» клетки.
БИОСИНТЕЗ РНК
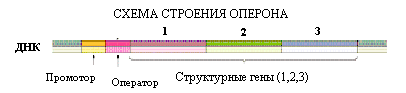
Транскрипция — биосинтез РНК на матрице ДНК. В отличие от репликации, транскрипции подвергается не вся молекула ДНК. Единицей транскрипции является оперон (у прокариот) или транскриптон (у эукариот).
Фермент транскрипции — РНК-полимераза — не требует праймера, синтезирует РНК в направлении от 5/-конца к 3/-концу, комплементарно и антипараллельно матричной цепи ДНК. Субстратами для синтеза РНК являются активированные нуклеотиды (АТФ, ГТФ, ЦТФ, УТФ).
Инициация транскрипции: холофермент РНК-полимеразы связывается с матрицей в области промотора, вызывает локальное плавление ДНК и начинает синтез РНК. Одна из субъединиц фермента (σ-фактор) отвечает только за узнавание промотора и после инициации синтеза отсоединяется от других субъединиц.
Структура РНК-полимеразы прокариот

Элонгация: наращивание цепи РНК осуществляет коровая полимераза.
Терминация: в гене имеются терминирующие последовательности; белковый ρ (ро)-фактор вызывает отсоединение РНК-полимеразы от матрицы. Образовавшаяся молекула РНК у прокариот содержит информацию о нескольких белках (полицистронный транскрипт) и сразу же подвергается трансляции.

В ядре у эукариот имеется 3 типа РНК полимераз (I — синтезирует рРНК, II — для иРНК, III — для тРНК). Все виды РНК синтезируются в виде предшественников и нуждаются в процессинге (созревании). После процессинга РНК транспортируется из ядра в цитоплазму.
Созревание иРНК. Во время синтеза пре-иРНК происходит модификация концов молекулы — кэпирование на 5/-конце и полиаденилирование на 3/-конце. Кэп («шапочка» из трифосфометилгуанозина) и полиадениловый «хвост» защищают иРНК от действия нуклеаз. Следующим этапом созревания РНК является сплайсинг — удаление интронов (неинформативных вставок) и сшивание экзонов (информативных участков). В сплайсинге участвует малая ядерная РНК, которая содержит последовательности, комплементарные интронам.
Созревание тРНК. От предшественника тРНК отщепляются дополнительные олигонуклеотиды на 3’- и 5’- концах, вырезаются интроны, достраивается акцепторный участок (ЦЦА), формируется петля антикодона, проводится модификация нуклеотидов (образуются псевдоуридин, дигидроуридин и т. п.).
Созревание рРНК. рРНК синтезируется в виде крупных предшественников, из которых затем удаляются интроны, молекулы разрезаются на фрагменты разного размера, метилируются, объединяются с белками (образуются малая и большая субъединицы рибосом).
Ингибиторы транскрипции:
- актиномицинД — препятствует раскручиванию ДНК и продвижению РНК-поли-меразы;
- рифампицин — ингибирует РНК-полимеразу прокариот на этапе инициации;
- α-аманитин (токсин бледной поганки) — ингибирует РНК полимеразу II эукариот.
БИОСИНТЕЗ БЕЛКА
Трансляция — биосинтез белка на матрице иРНК. Участники трансляции: иРНК, рибосомы, белковые факторы инициации, элонгации и терминации, ГТФ, аминоацил-тРНК.
Последовательность нуклеотидов иРНК определяет последовательность включения аминокислот в синтезируемый белок. При этом одну аминокислоту кодирует последовательность из трех нуклеотидов (триплет, кодон). Существует 43 = 64 кодона (3 из них не кодируют аминокислоты — бессмысленные или нонсенс-кодоны). Общий набор кодонов составляет генетический код. Свойства генетического кода: триплетность; специфичность (1 кодон —
1 аминокислота); вырожденность (или избыточность, 61 кодон для 20 аминокислот); однонаправленность; неперекрываемость; отсутствие знаков препинания; универсальность.
Роль тРНК в биосинтезе белка: 1) транспорт аминокислот на рибосомы; 2) адапторная функция, т. е. тРНК является посредником при переводе с языка нуклеиновых кислот (последовательность нуклеотидов) на язык белков (последовательность аминокислот). Адапторная функция осуществляется благодаря наличию в структуре тРНК акцепторного участка для аминокислоты и антикодона для связи с иРНК.
Рекогниция — процесс узнавания аминокислотой своей тРНК. Специфичность связывания обеспечивает фермент АРСаза (аминоацил-тРНК-синтетаза), который катализирует
2 реакции:
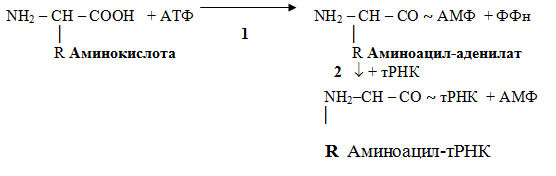
Собственно трансляция проходит в три этапа: инициация, элонгация и терминация.
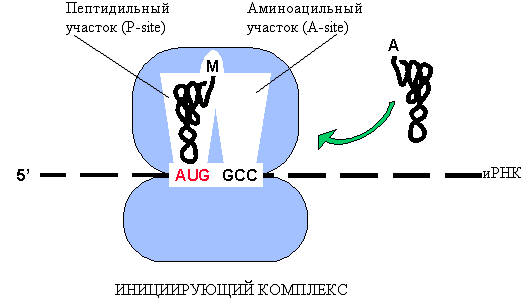
Инициация: иРНК поступает на ма-лую субъединицу рибосомы 5/-концом, к инициирующему кодону (АУГ) присоеди-няется первая аминоацил-тРНК (мет-тРНК), и комплекс «закрывается» большой субъединицей рибосомы. В образовании инициирующего комплекса участвуют белковые факторы инициации (IF-1, 2, 3) и используется энергия ГТФ.
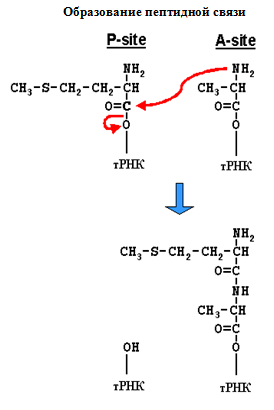
Элонгация: в аминоацильный участок поступает следующая аминоацил-тРНК. Фермент пептидилтрансфераза образует пептидную связь между активированной карбо-ксильной группой первой аминокислоты и аминогруппой второй аминокислоты. Образованный при этом дипептид «зависает» в аминоацильном центре. Затем с помощью транслоказы и энергии ГТФ рибосома перемещается по иРНК на один кодон, аминоацильный участок освобождается, туда поступает новая аминокислота.
Терминация наступает тогда, когда в аминоацильном участке оказывается один из терминирующих (нонсенс) кодонов. К таким кодонам присоединяются специальные белки (рилизинг-факторы), которые высвобождают синтезированный пептид и вызывают диссоциацию субъединиц рибосомы.
Многие белки синтезируются в неактивном виде (в виде предшественников) и после схождения с рибосом подвергаются постсинтетической модификации. Виды модификации белков:
- частичный протеолиз (удаление N-конце-вого мет и сигнального пептида, образование активных форм ферментов и гормонов);
- объединение протомеров и формирование четвертичной структуры белков;
- образование внутри- и межцепочечных S–S связей;
- ковалентное присоединение кофакторов к ферментам (пиридоксальфосфат, биотин);
- гликозилирование (гормоны, рецепторы);
- модификация остатков аминокислот:
- гидроксилирование про и лиз (коллаген);
- йодирование тир (тиреоидные гормоны);
- карбоксилирование глу (факторы свертывания крови);
- фосфорилирование (казеин молока, регуляция активности ферментов);
- ацетилирование (гистоны);
- пренилирование (G-белки).
Регуляция биосинтеза белка в клетке
Синтез белка в клетке можно регулировать на этапе транскрипции, созревания иРНК, транспорта ее из ядра в цитоплазму, изменяя стабильность иРНК, в процессе трансляции и посттрансляционной модификации. Регуляция на самых ранних этапах (на уровне экспрессии генов) является наиболее выгодной и потому широко используется.
Примером регуляции экспрессии генов является работа lac-оперона у E. coli. Lac-опе-рон содержит 3 структурных гена ферментов, участвующих в метаболизме лактозы. В отсутствие лактозы оперон заблокирован белком репрессором.
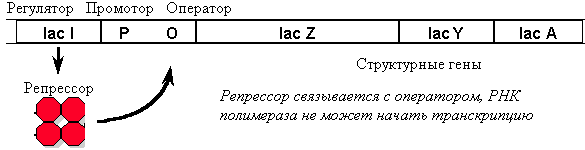
В присутствии индуктора (лактозы) репрессор меняет свою конформацию и отсоединяется от ДНК. Однако если в этот момент в среде имеется глюкоза (более доступный источник энергии), транскрипция не идет. В том случае, если глюкоза отсутствует, в клетке увеличивается уровень цАМФ (сигнал «голода») и цАМФ в комплексе со специальным белком (catabolite activator protein) связывается с промотором. Только в присутствии этого белка РНК-полимераза может образовать прочную связь с промотором и начать транскрипцию.
Белковые факторы, которые способствуют связыванию РНК-полимеразы с промотором, называются факторами транскрипции.

Регуляторная часть генов эукариот устроена более сложно. Имеются энхансеры (элементы, усиливающие транскрипцию), сайленсеры (ослабляющие), адапторные элементы. Факторы транскрипции могут связываться с любым из этих элементов, тем самым регулировать функции генов. В качестве индукторов биосинтеза белка на генетическом уровне могут выступать не только субстраты (лактоза для лактазы), но и стероидные гормоны, витамин Д, тиреоидные гормоны, ионы металлов и др.
