БИОХИМИЯ ПИТАНИЯ. МАКРО- И МИКРОЭЛЕМЕНТЫ
Все минеральные вещества в зависимости от их концентрации, подразделяются на макро- и микроэлементы. Содержание макроэлементов превышает 50 мг/кг массы тела (натрий и калий, кальций, магний, фосфат, хлорид, сульфат). Содержание микроэлементов составляет менее 50 мг/кг массы тела (медь, цинк, селен, кобальт и др.). К микроэлементам относят также и железо, хотя его концентрация превышает указанную величину.
МАКРОЭЛЕМЕНТЫ
Электролиты К+ и Na+ важны для поддержания электролитного баланса, надлежащего осмотического давления; они создают определённые условия растворимости, участвуют в механизмах возбудимости, влияют на обменные процессы путём активирования или ингибирования ферментов, используются в процессах минерализации костей скелета и зубов.
Концентрация электролитов вне и внутри клетки существенно различается: натрий и кальций преобладают во внеклеточном пространстве, калий и магний — внутри клетки.
Кальций
Общее содержание кальция в плазме крови — 2,2–2,7 ммоль/л. Половину составляет диффузионный Са2+ (способен проходить через биомембраны), часть Са2+ связана с белками крови (недиффузионный кальций), некоторое количество находится в составе цитратов и фосфатов плазмы крови. Основное депо кальция — Са-апатиты костной ткани. Кальций всасывается из кишечника в кровь с помощью специального Са2+-связывающего протеина, синтезируемого слизистой кишечника. Этот белок осуществляет свою функцию совместно с Са2+-зависимой АТФ-азой. Стимулятором синтеза Са2+-связывающего протеина является 1,25-(ОН)2-D3 (кальцитриол, витамин D3).
Роль кальция в организме. Соли кальция составляют основу скелета и зубов. Ионы кальция принимают участие в многочисленных процессах: регуляции нервно-мышечной возбудимости, сократительной и секреторной активности, проницаемости клеточных мембран. Са2+ активирует процесс свёртывания крови, адгезию и рост клеток. Наряду с циклическими нуклеотидами Са2+ считается вторичным посредником в реализации механизма действия гормонов.
Регулируется уровень кальция в крови гормонами-антагонистами: паратирином и тиреокальцитонином, а также витамином D.
Кальцитонин
Кальцитонин секретируется С-клетками щитовидной железы (ЩЖ). Это — полипептид (32 аминокислоты). Регулятор секреции — повышение концентрации Са++ в крови более 2,25 ммоль/л. Основной эффект гормона — снижение уровней Са++ и фосфора в крови. Он ускоряет минерализацию костной ткани и стимулирует включение в неё фосфора, ингибирует активность и уменьшает количество остеокластов. В почках гормон, связываясь с
7-ТМС-(R), которые расположены в дистальных канальцах, усиливает выведение фосфатов и кальция.
Паратирин (паратгормон)
Гормон синтезируется паращитовидными железами. Он является полипептидом (84 аминокислоты). Краткосрочная регуляция секреции паратгормона осуществляется Са++, а в течение длительного времени — 1,25(ОН)2D3 cовместно с кальцием.
Паратгормон взаимодействует с 7-ТМС-(R), что приводит к активации аденилатциклазы и повышению уровня цАМФ. Помимо этого, в механизм действия паратгормона включаются Са++, а также ИТФ и диацилглицерол (ДАГ). Основная функция паратгомона заключается в поддержании постоянного уровня и Са++. Эту функцию он выполняет, влияя на кости, почки и (посредством витамина D) кишечник. Влияние паратгормона на остеокласты ткани осуществляется в основном через ИТФ и ДАГ, что в конечном итоге стимулирует распад кости. В проксимальных канальцах почек паратгормон угнетает реабсорбцию фосфатов, что ведет к фосфатурии и гипофосфатемии, он увеличивает также реабсорбцию кальция, т. е. уменьшает его экскрецию. Кроме того, в почках паратгормон повышает активность
1-гидроксилазы. Этот фермент участвует в синтезе активных форм витамина D.
Поступление кальция в клетку регулируется нейрогормональными сигналами, одни из которых увеличивают скорость вхождения Са + в клетку из межклеточного пространства, другие — высвобождения его из внутриклеточных депо. Из внеклеточного пространства Са2+ попадает в клетку через кальциевый канал (белок, состоящий из 5 субъединиц). Кальциевый канал активируется гормонами, механизм действия которых реализуется через цАМФ. Высвобождение Са2+ из внутриклеточных депо происходит под действием гормонов, активирующих фосфолипазу С — фермент, способный гидролизовать фосфолипид плазматической мембраны ФИФФ (фосфатидилинозитол-4,5- бифосфат) на ДАГ (диацилглицерол) и ИТФ (инозитол-1,4,5-трифосфат):
ИТФ присоединяется к специфическому рецептору кальцисомы (где Са2+ аккумулируется). При этом изменяется конформация рецептора, что влечёт за собой открытие ворот, запиравших канал для прохождения Са2+ из кальцисомы. Высвободившийся из депо кальций связывается с протеинкиназой С, активность которой увеличивает ДАГ. Протеинкиназа С, в свою очередь, фосфосфорилирует различные белки и ферменты, изменяя тем самым их активность.
Ионы кальция действуют двумя путями: 1) связывают отрицательно заряженные группы на поверхности мембран, изменяя тем самым их полярность; 2) связываются с белком калмодулином, активируя тем самым множество ключевых ферментов обмена углеводов и липидов.
Недостаток кальция приводит к развитию остеопороза (хрупкости костей). К недостатку кальция в организме приводят дефицит его в пище и гиповитаминоз Д.
Суточная потребность — 0,8–1,0 г/сут.
В обмене кальция наряду с паратирином и тиреокальцитонином исключительно важную роль играет витамин Д.
Витамин Д (кальциферол), антирахитический
В животных жирах содержится холекальциферол (витамин Д3), в растительных — эргокальциферол Д2 (кальциферол означает несущий кальций). В организме человека витамин Д3 образуется в качестве промежуточного продукта при биосинтезе холестерола
(из 7-дегидрохолестерола) в клетках кожи под влиянием УФ-лучей.
Метаболизм. Кальциферолы поступают в печень в составе хиломикронов. В печени образуется 25(ОН)-Д3, т. е. 25-гидроксихолекальциферол, затем 25(ОН)-Д3 попадает в кровь и, связываясь специфическим транспортным белком, переносится в почки. В почках образуется 1,25(ОН)2-Д3 (1,25-дигидроксихолекальциферол, или кальцитриол). Эта реакция активируется паратиреоидным гормоном. В реакциях гидроксилирования принимает участие витамин С. Витамин Д3 накапливается в жировой ткани.
Биохимические функции. Витамин Д3 можно рассматривать как прогормон, так как его действие во многом сходно с действием стероидных гормонов. Так, проникая в клетки-мишени, он связывается с белковыми рецепторами, которые мигрируют в ядро клетки. В энтероцитах этот гормон-рецепторный комплекс стимулирует транскрипцию иРНК, передающую информацию для синтеза белка-переносчика ионов кальция. При этом всасывание кальция осуществляется как путём облегченной диффузии с участием этого переносчика, так и путём активного транспорта (с помощью Са2+-АТФ-азы). Одновременно ускоряется и всасывание фосфора.
Кроме кишечника органом-мишенью активной формы витамина Д является костная ткань, где 1,25(ОН)2-Д3 стимулирует процесс деминерализации (синергично с паратирином).
Активация витамином 1,25(ОН)2-Д3 кальциевой АТФ-азы мембран почечных канальцев приводит к увеличению реабсорбции Са2+; возрастает и реабсорбция фосфатов.
Кальцитриол принимает также участие в регуляции роста и дифференцировке клеток костного мозга. Он обладает антиоксидантным и антиканцерогенным действием.
Гиповитаминоз. Недостаток витамина Д у детей приводит к заболеванию рахитом. Основные проявления этого заболевания сводятся к симптоматике недостаточности кальция. У взрослых недостаточность кальция в организме приводит к кариесу и остеомаляции (размягчение кости); у пожилых — к развитию остеопороза (снижение плотности костной ткани вследствие нарушения остеосинтеза).
Гипервитаминоз Д. Избыточный приём витамина Д приводит к интоксикации и сопровождается выраженной деминерализацией костей — вплоть до их переломов. Содержание кальция в крови повышается. Это приводит к кальцификации мягких тканей, особенно почек (вторичный гиперпаратиреоидизм).
Суточная потребность для детей колеблется от 10 до 25 мкг (500–1000 МЕ), у взрослых она ниже. Витамин Д3 содержится исключительно в животной пище. Богаты им рыбий жир, печень, желток яиц. В растительных маслах, молоке, дрожжах присутствует витамин Д2 (биологически он менее активен).
Фосфор
Наибольшее его количество (85 %) находится в костной ткани. Фосфор — важнейший вне- и внутриклеточный анион. Внутри клетки он связан с белками и липидами («органический фосфор»). Фосфор внеклеточного пространства находится в виде одно- и двузамещённых фосфатов, образующих в плазме крови буферную систему (поддержка нормы рН). Фосфор является одним из ингредиентов, определяющих буферные свойства мочи.
Участие в метаболизме. Органический фосфор входит в состав нуклеиновых кислот, коферментов, фосфолипидов, он служит энергоносителем, входит в состав вторичных посредников гормонов, участвует в образовании коферментной формы водорастворимых витаминов. В клетках путём фосфорилирования осуществляется регуляция активности регуляторных ферментов.
Обмен фосфора тесно связан с процессами поступления и освобождения из костей кальция: увеличение поступление Са2+ в организм приводит к повышению выведения фосфора с мочой. Контроль внеклеточной концентрации фосфора осуществляется почками: под влиянием паратирина реабсорбция фосфатов снижается. Основными причинами гипофосфатемии являются гиперпаратиреоидизм, врожденный дефект реабсорбции фосфора в почках, недостаточность питания, онкологические заболевания.
Суточная потребность составляет около 1 г.
МИКРОЭЛЕМЕНТЫ
Железо
Содержание железа в организме — 3–5 г, наибольшее его количество (2/3) приходится на гемоглобин, 4,5 % — на миоглобин, 2 % находится в составе ферментов. Оно может быть геминовым (железо гема и других порфиринов) либо негеминовым (в составе фермента аконитазы и железосерных белков, входящих в комплексы дыхательной цепи). Fe принимает участие в связывании, транспорте и депонировании О2 (гемоглобин и миоглобин), в транспорте электронов в дыхательной цепи (цитохромы), в окислительно-вос-становительных реакциях (некоторые оксидоредуктазы), реакциях гидроксилирования (цитохром Р450) и обезвреживания перекисей (каталаза и пероксидазы).
Железо всасывается в верхней части тонкого кишечника. При возрастании потребности в нём (кровопотери) Fe всасывается эффективнее. Улучшает всасывание железа витамин С. Фосфаты и фитаты зерновых растений затрудняют его всасывание. Из просвета кишечника свободное железо захватывается муцином слизистой. Интегрин на поверхности мембраны щёточной каёмки энтероцита облегчает транспорт Fe внутрь клетки, где железо связывается с белком мобилферрином. Этот белок «собирает» железо изо всех отсеков цитозоля энтероцита и переносит Fe в кровь, где Fe3+ сразу же связывается с белком апотрансферрином — образуется трансферрин (гликопротеин). Трансферрин, помимо транспортной функции, защищает также ткани от токсического действия свободных ионов железа. Затем, связываясь со специфическим мембранным рецептором, трансферрин поступает вместе с ним в клетки кроветворных органов. После освобождения от Fe трансферриновый рецептор возвращается в плазматическую мембрану.
В клетках печени, костного мозга и селезёнки железо связывается с апоферритином. Этот белок состоит из 24 субъединиц, формирующих 6 каналов, через которые в центральную часть молекулы поступают ионы железа. 1 молекула апоферритина может заключать в себе до 4,5 тысяч атомов железа. Апоферритин, связанный с Fe, называется ферритином. Железо может быть снова использовано только после распада ферритина. При загрузке депо (феррритина) Fe откладывается в виде нерастворимого комплекса — гемосидерина.
Физиологические потери железа при обновлении эпителия кишечника незначительны. Особенностью обмена Fe является неспособность организма экскретировать его большие количества. В норме между скоростью всасывания и выведения железа существует равновесие. Существенный дефицит железа может возникать при кровопотере (с 1 мл крови теряется 0,5 мг Fe). Недостаток Fe возникает также при потреблении бедной железом пищи и нарушениях его всасывания. В результате развивается железодефицитная гипохромная анемия. Избыточное отложение Fe в виде гемосидерина в клетках печени и селезёнки отмечается при переливании больших объёмов крови или гемолизе эритроцитов.
Суточная потребность в железе для взрослых — 1–2 мг. Однако всасывается лишь 10 % содержащегося в рационе питания Fe.
Медь
Всасываясь из слизистой кишечника, медь в портальном кровотоке адсорбируется альбуминами и белком транскупреином и поступает в печень — центральный орган обмена меди. В печени медь либо запасается, либо включается в Cu-содержащие ферменты. В плазме крови Cu связывается с ферментом церулоплазмином (α2-глобулин), имеющим голубую окраску. Церулоплазмин обладает оксидазной активностью (окисляет аскорбиновую кислоту, адреналин, ДОФА и др.). Он играет ведущую роль во взаимосвязи обмена Cu и Fe.
Роль меди в обмене веществ. Медь входит в состав многих ферментов: цитохромоксидазы (фермент дыхательной цепи), моноаминоксидазы (обезвреживание биогенных аминов), церулоплазмина, каталазы (обезвреживание Н2О2), тирозиназы (синтез меланина), супероксиддисмутазы (обезвреживание О2–), лизилоксидазы (синтез коллагена и эластина).
Суточная потребность — 2–3 мг. При недостатке меди в рационе может развиваться железодефицитная анемия, так как медь непосредственно участвует в метаболизме железа.
Селен
Селен является дефицитным и абсолютно незаменимым микроэлементом. Он является мощным антиоксидантом, защищая ткани от свободнорадикальной деструкции как самостоятельно (например, защищая SH-группы от окисления), так и в составе глутатиопероксидазы (Se входит в состав её активного центра) — важнейшего фермента антиоксидантной системы организма. Селен — составная часть тироксин-5-дейодазы, обеспечивающей синтез гормона щитовидной железы — трийодтиронина. Селен — классический антиканцероген, что объясняется его антиоксидантными свойствами.
Суточная потребность — 100 мкг.
БИОХИМИЯ ПИТАНИЯ. ВИТАМИНЫ И ДРУГИЕ НЕЗАМЕНИМЫЕ ФАКТОРЫ ПИТАНИЯ. СИНДРОМ НЕДОСТАТОЧНОГО ПИТАНИЯ
Питательное вещество — компонент пищи, который обеспечивает организм структурно-функциональными компонентами или энергией.
Условно различают три важнейших категории питательных веществ:
- энергодающие (белки, углеводы и липиды);
- микрокомпоненты (витамины и минеральные соединения, необходимые для биохимических процессов);
- волокнистые соединения (неперевариваемые полисахариды).
Незаменимый фактор питания — вещество, поступающее в организм с пищей, поскольку в самом организме оно не может образовываться в достаточном количестве.
Известные на сегодняшний день незаменимые факторы питания для человека:
- вода;
- энергия или калории из углеводов, жиров или белка;
- 8–10 незаменимых аминокислот;
- незаменимые жирные кислоты;
- 14 витаминов;
- 16–20 минеральных компонентов-микроэлементов.
Энергетические потребности организма взрослого человека в состоянии покоя составляют 1300–1800 ккал. Они увеличиваются при ожогах, травмах, инфекционных заболеваниях, в послеоперационный период. При голодании они снижаются. Основными источниками энергии являются углеводы — 42 %, жиры — 40 %, белки — 15 % и алкоголь — 3 %. Желательно, чтобы 55 % АТФ образовывалось в результате расщепления углеводов, 30 % — липидов, 15 % — белков.
Энергия, выделяющаяся в ходе расщепления в организме продуктов питания — источников энергии, запасается в виде АТФ. В состоянии покоя 22 % образовавшегося АТФ расходуется на работу Na+, K+ АТФ-азы, 21 % — на биосинтез белка, 10 % — на перенос ионов кальция через биологические мембраны и 11 % — на мышечное сокращение.
Витамины
| Витамин | Функции | Гиповитаминоз | |
| А | Ретинол
β-каротин |
Зрительные пигменты в сетчатке; регуляция экспрессии генов и клеточной дифференцировки | «Куриная слепота», ксерофталмия; кератинизация кожи, ксеростомия, гипоплазия эмали |
| Д | Кальциферол | Поддержание баланса Са2+; стимуляция всасывания Са2+ в кишечнике и реабсорбции в почках; регуляция экспрессии генов и клеточной дифференцировки | Рахит = плохая минерализация костной ткани; остеомаляция = деминерализация кости, гипоплазия эмали и патологическая стираемость зубов |
| Е | Токоферолы
токотриенолы |
Антиоксидант, особенно в клеточных мембранах; роль в передаче клеточного сигнала | Чрезвычайно редко — выраженные неврологические расстройства |
| К | Филлохинон
менахиноны |
Кофермент в образовании -карбоксиглутамата в составе ферментов свертывания крови и матрикса кости | Нарушение свертывания крови, геморрагический синдром, нарушение минерализации тканей зуба и кости |
| В1 | Тиамин | Кофермент пируват и -кетоглутарат дегидрогеназ, транскетолазы; участвует в проведении нервного импульса, регулируя Сl–-каналы | Поражение периферической нервной системы (бери-бери) или ц. н. с. (синдром Вернике-Корсакова) |
| В2 | Рибофлавин | Кофермент в окислительно-восстановительных реакциях; простетическая группа флавопротеинов | Повреждение уголков рта, губ и языка, себорейный дерматит |
| РР | Ниацин, никотиновая кислота, никотинамид | Кофермент в окислительно-восстановительных реакциях, составной компонент НАД+ и НАДФ+; роль в регуляции внутриклеточного Са2+ и проведении сигнала в клетку | Пеллагра — синдром 3-х «Д» |
| В6 | Пиридоксин
пиридоксаль пиридоксамин |
Кофермент в реакциях трансаминирования и декарбоксилирования аминокислот, гликоген фосфорилазы; модуляция действия стероидных гормонов | Нарушение метаболизма аминокислот, судороги |
| Фолиевая кислота | Кофермент в транспорте одноуглеродных фрагментов | Мегалобластическая анемия | |
| В12 | Кобаламин | Кофермент в транспорте одноуглеродных фрагментов и метаболизме фолиевой кислоты | Пернициозная анемия = мегалобластическая анемия и дегенерация спинного мозга |
| Пантотеновая кислота | Функциональная часть КоА и ацилпереносящего белка в составе ацилсинтетазы | Поражение периферической нервной системы («синдром жжения стоп») | |
| Н | Биотин | Кофермент в реакциях карбоксилирования (глюконеогенез, синтез жирных кислот); роль в регуляции клеточного цикла | Нарушение липидного и углеводного обменов, дерматит |
| С | Аскорбиновая кислота | Кофермент в гидроксилировании пролина и лизина (синтез коллагена); антиоксидант; усиливает всасывание железа | Цинга (плохое заживление, потеря цемента зубов, подкожные кровоизлияния) |
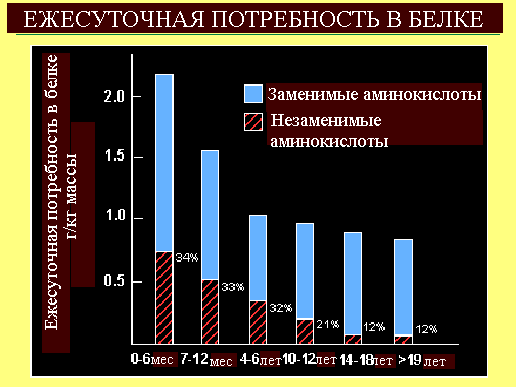
Синдром недостаточного питания — патологическое состояние, обусловленное несоответствием поступления и расхода питательных веществ, приводящее к снижению массы тела и изменению компонентного состава организма.
Причины: социальные, экономические, биологические, экологические.
Биологические причины — внешние факторы (плохое питание, травмы, инфекции) и внутренние (нарушение переваривания, всасывания и усвоения пищевых веществ в организме). Существуют 2 основных клинических формы недостаточности питания: квашиоркор и маразм (кахексия)
| Клинические формы | Квашиоркор
(ранний период после тяжелых травм, ожогов, обширных хирургических вмешательств) |
Маразм
(например, при онкологических заболеваниях) |
| Первопричина | Дефицит белка из-за отсутствия его в пище или нарушения всасывания | Общая нехватка источников энергии |
| Отек | Имеет место вследствие снижения онкотического давления в кровеносных сосудах (гипоальбуминемия) | Отсутствует |
| Гипоальбуминемия | «Низкий альбумин» в плазме крови — основной симптом. В печени сокращается продукция альбумина, чтобы сохранить потерю белка | Отсутствует |
| Ожирение печени | Имеет место низкое содержание белка в пище, как правило, сочетается с высоким потреблением углеводов | Отсутствует |
| Уровень инсулина в крови |
Поддерживается на нормальном уровне | Низкий — в организме преобладают катаболические процессы, направленные на извлечение энергии из любых оставшихся депо |
| Уровень адреналина в крови |
Нормальный | Высокий |
| Потеря мышечной массы | Отсутствует или слабая | Да — может быть выраженной вследствие катаболизма белков |
| Жировые запасы | Некоторая потеря | Их нет |
| Характер течения в зависимости от времени |
Острое — выраженный катаболический ответ в короткий период времени | Постепенно — нерезкий катаболический ответ на голодание (может занимать длительный период времени) |
| Сниженная пигментация |
Может иметь место — для пигментации нужны аминокислоты (тирозин). Бледный вид |
