БИОХИМИЯ МЫШЕЧНОЙ ТКАНИ
Мышцы составляют у взрослого человека 40 % от массы тела.
Функция мышц — напряжение и укорочение с последующим расслаблением.
Значение мышц — обеспечение подвижности организма и сопротивление механической силе, в том числе и статические нагрузки.
Механизм работы мышц — превращение химической энергии в механическую.
К мышечной ткани относятся:
- скелетная мускулатура;
- сердечная мышца;
- гладкая мускулатура.
Скелетная и сердечная мышцы под микроскопом имеют поперечно-полосатое строение, а гладкая — нет. Мышечные клетки состоят из миофибрилл, а функциональной единицей миофибрилл является саркомер.
![]()
![]()

При рассмотрении миофибриллы под электронным микроскопом видны темные и светлые полосы или диски (А и I диски). Центральная зона А диска (H зона) при этом кажется менее оптически плотной, чем остальная его часть. I участок (или I диск) как бы делится на две части очень плотной и узкой Z-линией. Также видны два типа вытянутых нитей. Один тип — это толстая нить, соответствующая А диску. Второй тип — тонкая нить, расположена в I диске и проходит в А диск, не достигая Н зоны.
Около 25 % массы мышц составляют белки. Белки мышц делят на 3 группы:
- миофибриллярные (сократительные) белки;
- белки саркоплазмы;
- белки стромы.
Миофибриллярные (сократительные) белки
1. Миозин — основа толстых нитей. Молекулярная масса ≈ 500.000 Да. Молекула миозина имеет вытянутую часть, состоящую из двух спиралей, накрученных одна на другую. Каждая спираль имеет на одном конце глобулярную головку и называется тяжёлой цепью. Возле головок спиралей располагается по 2 лёгких цепи.
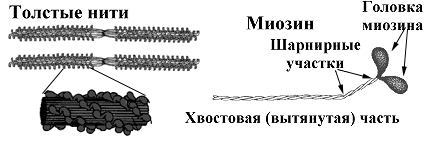
При обработке ферментами молекула миозина распадается на 2 больших фрагмента: тяжёлый меромиозин (обе головки и часть двойной спирали) и лёгкий меромиозин (остальная часть двойной спирали).
Функции миозина:
- структурная — около 400 молекул миозина соединяются между собой «хвост» в «хвост» и образуют толстую нить;
- каталитическая — головка миозина способна расщеплять АТФ;
- контактная — соединяется с актином своими головками, которые в таком случае называются «поперечные мостики».
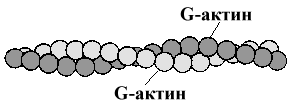
2. Актин — белок тонких нитей. Молекулярная масса — 42.000 Да. Форма молекул — шаровидная, поэтому он и называется G-актин (от англ. globular). Молекулы G-актина соединяются между собой и образуют F-актин (фибриллярный) в виде двойной спирали.
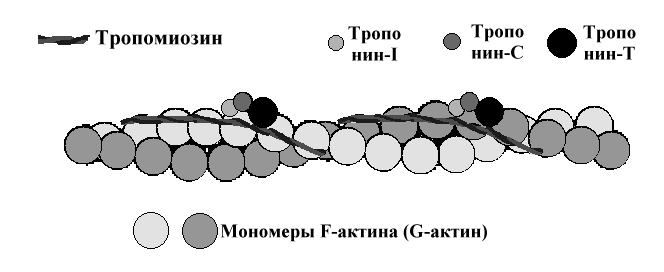
3. Тропомиозин — также белок тонких нитей. Молекулярная масса — 65.000 Да. Состоит из двух α-спиралей в форме палочки. Располагается в бороздках, идущих вдоль обеих сторон актина. Каждая его молекула лежит на 7 молекулах актина.
4. Тропонин — ещё один белок тонких нитей. Молекулярная масса — 80.000 Да. Состоит из 3 субъединиц: С — для связывания с ионами кальция; I — ингибиторная, которая блокирует преждевременное соединение головок миозина с актином; Т — для связывания с тропомиозином.
5. α-актинин. Входит в Z-линию и фиксирует там тонкие нити.
6. β-актинин. Регулирует длину тонких нитей.
7. М-белок. Входит в М-линию и фиксирует там толстые нити.
8. С-белок. Регулирует длину толстых нитей.
9. Десмин. Содержится между Z-линиями соседних миофибрилл, обеспечивая совпадение границ всех их саркомеров.
Белки саркоплазмы. К ним относятся миоглобин, ферменты гликолиза, тканевого дыхания, кальмодулин и кальсеквестрин, способные обратимо связываться с ионами кальция.
Белки стромы. Это коллаген и эластин.
Мышцы, помимо белков, содержат небелковые азотистые соединения — АТФ, КФ (креатинфосфат), фосфолипиды, глутамат, глутамин, карнозин и анзерин (два последних способны увеличивать амплитуду мышечного сокращения); безазотистые соединения — гликоген, лактат, пируват, нейтральные жиры, холестерол. Остальная масса — Н2О.
Молекулярный механизм мышечного сокращения
В ответ на нервный импульс происходит выброс ионов кальция из саркоплазматического ретикулума (СПР). Эти ионы связываются с лёгкими цепями миозина, при этом в головке расщепляется АТФ и головка готова присоединиться к актину. Ионы кальция затем связываются с тропонином С и меняют его конформацию. Эти изменения в силу эффекта кооперации передаются на субъединицу I и блокируют её. Далее изменения достигают субъединицы Т, которая и сдвигает в сторону молекулу тропомиозина, освобождая сразу 7 молекул актина. Головка миозина соединяется с актином, и образуется «поперечный мостик». Как только это произошло, АДФ и Фн уходят, головка наклоняется в сторону М-линии и тянет за собой тонкую нить. Затем к головке миозина присоединяется новая молекула АТФ, головка отделяется от нити актина, а гидролиз АТФ возвращает головку в вертикальное положение. Далее всё повторяется. Информацией о конце сокращения служит снижение концентрации ионов кальция в СПР. Тогда кальциевый насос и белок кальсеквестрин убирают избыток ионов кальция из цитоплазмы в СПР. Мышца переходит в состояние покоя.

Особенности гладких мышц:
- их сократительный аппарат не содержит тропониновой системы, а содержит специальный белок кальдесмон, который выполняет функцию тропонина;
- их миозиновая АТФазная активность в 10 раз ниже;
- их миозин может соединяться с актином только при условии фосфорилирования лёгких цепей;
- богаты белками стромы, но бедны фосфолипидами и макроэргами.
Гладкие мышцы — медленные, но способны длительно поддерживать напряжение.
Кроме того, они похожи на сердечную мышцу тем, что сокращаются непроизвольно.
Источники энергии мышечного сокращения
В состоянии покоя. Свободные жирные кислоты (СЖК) и кетоновые тела (КТ).
При умеренной нагрузке. СЖК + КТ + глюкоза крови.
При максимальной нагрузке. СЖК + КТ + глюкоза крови + гликоген мышц.
Механизмы энергообеспечения мышечного сокращения
- Основной регулятор энергетики мышечной клетки — это отношение [АТФ]/[АДФ]∙[Фн]. В покое концентрация АТФ высокая, а АДФ — низкая, в результате чего тормозится активность ключевых ферментов гликолиза, цикла Кребса и работа дыхательной цепи. С началом работы мышц концентрация АТФ падает, а АДФ возрастает, что приводит к активации вышеназванных процессов.
- Накапливающийся при работе мышц лактат поступает из крови в печень, где путём глюконеогенеза превращается в глюкозу, которая поступает сначала в кровь, а затем в мышцы, где восстанавливает запас гликогена.
- Аденилаткиназная (миокиназная) реакция:
2 АДФ ↔ АТФ + АМФ.
АТФ используется для мышечного сокращения, а АМФ стимулирует гликолиз.
- Креатинкиназная реакция:
Креатин + АТФ↔КФ + АДФ.
Покоящиеся мышцы содержат в 10–20 раз больше КФ, чем АТФ, но КФ, в отличие от АТФ, не может использоваться мышцами для сокращения. Роль КФ заключается в том, что он является не только транспортной формой энергии в мышцах, но и отдаёт свою богатую энергией связь АДФ для образования АТФ, который и расходуется при сокращении. Это система быстрого реагирования: она включается первой при нехватке АТФ в мышцах. Запаса КФ хватает только на 10 с, но за это время запускаются 1–3-й механизмы. Особенно эта система важна для миокарда, так как он очень чувствителен к недостатку кислорода и имеет исключительно аэробный характер обмена в отличие от скелетной мускулатуры.
