3.5. Белки
Биология — Тейлор Д., Грин Н., Стаут У. 1 том — 2013
Белки построены из аминокислот, и следовательно, в состав их молекул всегда входят углерод, водород, кислород и азот. В некоторых белках присутствует еще и сера. Часть белков образует комплексы с другими молекулами, содержащими фосфор, железо, цинк и медь. Молекулы белков — цепи, построенные из аминокислот, — очень велики; они представляют собой макромолекулы, молекулярная масса которых колеблется от нескольких тысяч до нескольких миллионов.
Белки являются полимерами, а аминокислоты — их мономерные звенья. В природных белках встречаются двадцать различных аминокислот.
Потенциально разнообразие белков безгранично, поскольку каждому белку свойственна своя особая аминокислотная последовательность (гл. 23), генетически контролируемая, т. е. закодированная в ДНК клетки, вырабатывающей данный белок. Белков в клетках больше, чем каких-либо других органических соединений: на их долю приходится свыше 50% общей сухой массы клеток. Они служат важным компонентом пищи животных и могут превращаться в животном организме как в жир, так и в углеводы.
Большое разнообразие белков позволяет им выполнять в живом организме множество различных функций, не только структурных, но и метаболических.
3.5.1. Размеры белковых молекул
Простые пептиды, состоящие из двух, трех или четырех аминокислотных остатков, называются соответственно ди-, три- и тетрапептидами. Полипептидами называются цепи, образованные большим числом аминокислотных остатков (до нескольких тысяч; табл. 3.6). Белковая молекула может состоять из одной или нескольких полипептидных цепей.

3.5.2. Классификация белков
Сложность строения белковых молекул и чрезвычайное разнообразие их функций крайне затрудняют создание единой четкой классификации белков на какой-либо одной основе. В табл. 3.7–3.9 приведены три разные классификации белков, основанные на различных их характеристиках.
Таблица 3.7. Классификация белков по их структуре
| Класс белков | Характеристика | Функция |
| Фибриллярные |
|
Выполняют в клетках и в организме структурные функции. К этой группе относятся, например, коллаген (сухожилия, кости, соединительная ткань), миозин (мышцы), фиброин (шелк, паутина), кератин (волосы, рога, ногти, перья) |
| Глобулярные |
|
Выполняют функции ферментов, антител и в некоторых случаях гормонов (например, инсулин), а также ряд других важных функций |
| Промежуточные | Фибриллярной природы, но растворимые | Примером может служить фибриноген, превращающийся в нерастворимый фибрин при свертывании крови |
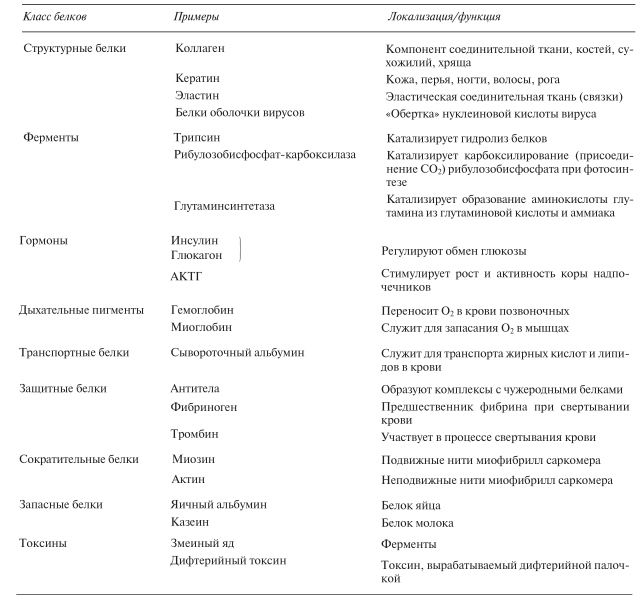
Таблица 3.8. Классификация белков по их составу

Таблица 3.9. Классификация белков по их функциям. Белки играют важную роль также в мембранах, где они функционируют как ферменты, рецепторы и транспортные белки
3.5.3. Структура белков
Каждому белку свойственна своя особая геометрическая форма, или конформация. Для описания трехмерной структуры белков рассматривают обычно четыре уровня организации, которые мы здесь и опишем.
Первичная структура
Под первичной структурой понимают последовательность аминокислот в полипептидной цепи.
Первым исследователем, определившим аминокислотную последовательность молекулы белка, был Фред Сэнгер (Fred Sanger), работавший в Кавендишской лаборатории Кембриджского университета, той самой, где Уотсон и Крик определили структуру ДНК. Сэнгер работал с гормоном инсулином — самым маленьким белком, какой ему удалось найти. Работа заняла 10 лет и результаты ее были опубликованы в 1953 г. (рис. 3.28).

Другой выдающийся молекулярный биолог из Кавендиша, Макс Перуц (Max Perutz), вспоминал: «открытие это явилось сенсацией, ибо в первый раз было показано, что аминокислоты в полипептидных цепях белка располагаются совершенно определенным образом». В 1958 г. Сэнгер за эту работу был удостоен Нобелевской премии (вторую Нобелевскую примию он получил за изучение структуры нуклеиновых кислот). В молекулу инсулина входит 51 аминокислота. Молекула состоит из двух полипептидных цепей, удерживаемых вместе дисульфидными мостиками.
В настоящее время большая часть работ по определению аминокислотных последовательностей автоматизирована, и теперь первичная структура известна уже более, чем для сотни тысяч белков. На рисунке 3.29 изображена первичная структура еще одного белка — фермента лизоцима.

Таблица 3.6 дает представление о числе аминокислотных остатков в молекулах некоторых белков. В организме человека тысячи различных белков, и все они построены из одних и тех же 20 стандартных аминокислот. Аминокислотная последовательность белка определяет его биологическую функцию. В свою очередь эта аминокислотная последовательность определяется нуклеотидной последовательностью ДНК (гл. 23).
Замена одной-единственной аминокислоты в молекуле данного белка может резко изменить его функцию, как это наблюдается, например, при так называемой серповидноклеточной анемии (гл. 25). Интересные данные могут быть получены в результате анализа аминокислотных последовательностей гомологичных белков, принадлежащих разным биологическим видам; такие данные позволяют судить о возможном таксономическом родстве между этими видами. Вопрос этот будет обсуждаться в гл. 26.
Вторичная структура
Для всякого белка характерна, помимо первичной, еще и определенная вторичная структура. Обычно белковая молекула напоминает растянутую пружину. Это так называемая а-спираль, стабилизируемая множеством водородных связей, возникающих между находящимися поблизости друг от друга CO- и NH-группами. Атом водорода NH-группы одной аминокислоты образует такую связь с атомом кислорода CO-группы другой аминокислоты, отстоящей от первой на четыре аминокислотных остатка (рис. 3.30).

Таким образом, аминокислота 1 оказывается связанной с аминокислотой 5, аминокислота 2 — с аминокислотой 6 и т. д. Рентгеноструктурный анализ показывает, что на один виток спирали приходится 3,6 аминокислотного остатка. Полностью а-спиральную конформацию и, следовательно, фибриллярную структуру имеет белок кератин. Это структурный белок волос, шерсти, ногтей, клюва, перьев и рогов, входящий также в состав кожи позвоночных.
Твердость и растяжимость кератина варьируют в зависимости от числа дисульфидных мостиков между соседними полипептидными цепями (от степени сшивки цепей). Теоретически все CO- и NH-группы могут участвовать в образовании водородных связей, так что а-спираль — это очень устойчивая, а потому и весьма распространенная конформация.
Участки а-спирали в молекуле напоминают жесткие стержни. Тем не менее большинство белков существует в глобулярной форме, в которой также имеются участки бета-слоя (см. ниже) и участки с нерегулярной структурой. Объясняется это тем, что образованию водородных связей препятствует ряд факторов: наличие некоторых аминокислотных остатков в полипептидной цепи, наличие дисульфидных мостиков между различными участками одной и той же цепи и, наконец, тот факт, что аминокислота пролин вообще неспособна образовывать водородные связи.
Бета-слой, или складчатый слой — это другой тип вторичной структуры. Белок шелка фиброин, выделяемый шелкоотделительными железами гусениц шелкопряда при завивке коконов, представлен целиком именно этой формой.
Фиброин состоит из ряда полипептидных цепей, вытянутых сильнее, чем цепи с конформацией а-спирали. Эти цепи уложены параллельно, но соседние цепи по своему направлению противоположны одна другой (антипараллельны; рис. 3.31).

Они соединены друг с другом при помощи водородных связей, возникающих между CO- и NH- группами соседних цепей. В этом случае в образовании водородных связей также принимают участие все NH- и CO-группы, т. е. структура тоже весьма стабильна. Такая конформация полипептидных цепей называется бета-конформацией, а структура в целом — складчатым слоем.
Фиброин обладает высокой прочностью на разрыв и не поддается растяжению, но подобная организация полипептидных цепей делает шелк очень гибким. В глобулярных белках полипептидная цепь может складываться на себя, и тогда в этих точках глобулы возникают участки, имеющие структуру складчатого слоя.
Еще один способ организации полипептидных цепей мы находим у фибриллярного белка коллагена. Это тоже структурный белок, обладающий подобно кератину и фиброину высокой прочностью на разрыв. У коллагена три полипептидные цепи свиты вместе, как пряди в канате, образуя тройную спираль. В каждой полипептидной цепи этой сложной спирали, называемой тропоколлагеном, содержится около 1000 аминокислотных остатков. Отдельная полипептидная цепь представляет собой свободно свернутую спираль (но не а-спираль; рис. 3.32).

Три цепи удерживаются вместе водородными связями. Из многих тройных спиралей, располагающихся параллельно друг другу и удерживаемых вместе ковалентными связями между соседними цепями, образуются фибриллы. Они в свою очередь объединяются в волокна. Структура коллагена формируется, таким образом, поэтапно — на нескольких уровнях — подобно структуре целлюлозы. Коллаген также невозможно растянуть, и это его свойство существенно для той функции, которую он выполняет, например, в сухожилиях, костях и других видах соединительной ткани.
Белки, существующие только в полностью спирализованной форме, подобно кератину и коллагену, представляют собой исключение среди прочих белков.
Третичная структура
У большинства белков полипептидные цепи свернуты особым образом в компактную глобулу. Способ свертывания полипептидных цепей глобулярных белков называется третичной структурой. Третичная структура поддерживается уже обсуждавшимися выше связями трех типов — ионными, водородными и дисульфидными, а также гидрофобными взаимодействиями (рис. 3.33).

В количественном отношении наиболее важны именно гидрофобные взаимодействия; белок при этом свертывается таким образом, чтобы его гидрофобные боковые цепи были скрыты внутри молекулы, а гидрофильные, наоборот, выставлены наружу.
Для определения третичной структуры белка можно использовать метод рентгеновского анализа. В результате исследований, растянувшихся на несколько лет, Джон Кендрью и Макс Перуц (Kendrew, Perutz) к началу 1959 г. определили этим методом вторичную и третичную структуру миоглобина и предложили модель его молекулы (рис. 3.34).


За эту работу в 1962 г. они были удостоены Нобелевской премии. Теперь для миоглобина были известны:
первичная структура — молекула представляет собой одну полипептидную цепь, построенную из 153 аминокислотных остатков (их последовательность была установлена в начале 60-х годов);
вторичная структура — около 75% цепи имеет а-спиральную конформацию (восемь спиральных участков);
третичная структура — а-спираль свернута нерегулярным образом в компактную глобулу;
простетическая группа — гемогруппа, или гем (содержит железо).
Миоглобин синтезируется в мышцах, где он служит для запасания кислорода. Как и в гемоглобине, кислород в его молекуле связывается с гемом; от гема зависит красный цвет мышц.
Подробнее о функциях миоглобина мы будем говорить в гл. 14. Определение третичной структуры белков все еще остается весьма трудоемким процессом. В последнее время в молекулярной биологии все больше усилий затрачивается на попытки использовать компьютеры и прочую технику, которая позволила бы предсказывать третичную структуру белка исходя из его уже известной первичной и вторичной структуры. Это открыло бы возможности для конструирования белков с определенной структурой, предназначенных для определенных функций, что могло бы сыграть очень важную роль и в промышленности, и в медицине. На рис. 3.34 представлено несколько способов изображения третичной структуры белка. Еще один способ показан на рис. 3.35.

У белков с третичной структурой функция теснейшим образом зависит от точной формы молекулы. В этом особенно легко убедиться при знакомстве с ферментами (разд. 4.1.2).
Четвертичная структура
Многие белки с особо сложным строением состоят из нескольких полипептидных цепей, удерживаемых в молекуле вместе за счет гидрофобных взаимодействий, а также при помощи водородных и ионных связей. Способ совместной упаковки и укладки этих полипептидных цепей называют четвертичной структурой белка.
Четвертичная структура имеется, например, у гемоглобина — красного пигмента, содержащегося в эритроцих позвоночных, связывающего и переносящего кислород. Молекула гемоглобина состоит из четырех отдельных полипептидных цепей двух разных типов: из двух а-цепей и двух бета-цепей. Цепи эти по своему строению напоминают полипептидную цепь миоглобина.
Две а-цепи содержат по 141 аминокислотному остатку, а две бета-цепи — по 146 остатков. Полную структуру гемоглобина определили Кендрью и Перуц. В схематическом виде она представлена на рис. 3.36.

Как и у других глобулярных белков, гидрофобные боковые цепи гемоглобина скрыты внутри молекулы, а гидрофильные выставлены наружу, что делает гемоглобин растворимым в воде. Мутация, вызывающая замену одной из гидрофильных аминокислот на гидрофобную и тем самым снижающая растворимость гемоглобина, служит причиной болезни, известной как серповидноклеточная анемия (гл. 25).
Некоторые вирусы, например вирус табачной мозаики, имеют белковую оболочку, состоящую из многих полипептидных цепей, упакованных высокоупорядоченным образом (см. рис. 2.18).
3.5.4. Денатурация и ренатурация белков
Под денатурацией понимают утрату трехмерной конформации, присущей данной белковой молекуле. Это изменение может носить временный или постоянный характер, но и в том, и в другом случае аминокислотная последовательность белка остается неизменной. При денатурации молекула развертывается и теряет способность выполнять свою обычную биологическую функцию.
Вызывать денатурацию белков могут разнообразные факторы, перечисленные ниже.
НАГРЕВАНИЕ ИЛИ ИЗЛУЧЕНИЯ, например инфракрасное или ультрафиолетовое. Кинетическая энергия, сообщаемая белку, вызывает вибрацию его атомов, вследствие чего слабые водородные и ионные связи разрываются, и белок свертывается (коагулирует).
СИЛЬНЫЕ КИСЛОТЫ, СИЛЬНЫЕ ЩЕЛОЧИ И КОНЦЕНТРИРО- ВАННЫЕ РАСТВОРЫ СОЛЕЙ. Под действием этих реагентов ионные связи разрываются и белок коагулирует. Длительное воздействие реагента может вызвать разрыв и пептидных связей.
ТЯЖЕЛЫЕ МЕТАЛЛЫ. Положительно заряженные ионы тяжелых металлов (катионы) образуют прочные связи с отрицательно заряженными карбоксил-анионами R-групп белка и часто вызывают разрывы ионных связей. Они также снижают электрическую поляризацию белка, уменьшая его растворимость. Вследствие этого находящийся в растворе белок выпадает в осадок.
ОРГАНИЧЕСКИЕ РАСТВОРИТЕЛИ И ДЕТЕРГЕНТЫ. Эти реагенты нарушают гидрофобные взаимодействия и образуют связи с гидрофобными (неполярными) группами. В результате разрываются и внутримолекулярные водородные связи. Использование спирта в качестве дезинфицирующего средства основано именно на том, что он вызывает денатурацию белка любых присутствующих бактерий.
Ренатурация
Иногда денатурированный белок в подходящих условиях вновь спонтанно приобретает свою нативную структуру. Этот процесс называется ренатурацией. Ренатурация убедительно показывает, что третичная структура белка полностью определяется его первичной структурой и что сборка биологических объектов может осуществляться на основе немногих общих принципов.
