Глава 2. Антипсихотические препараты
Руководство по психофармакотерапии. Джордж Арана, Джеральд Розенбаум — 2004
- Химическая структура
- Фармакология антипсихотических средств
- Механизм действия антипсихотических средств
- Показания антипсихотических средств
- Терапевтическое применение антипсихотических препаратов
- Применение антипсихотических препаратов во время беременности и лактации
- Применение у пожилых
- Побочные эффекты и токсичность
- Передозировка
Антипсихотические препараты являются основными средствами лечения шизофрении и других психозов, таких как шизоаффективное расстройство или органические психозы. Антипсихотические препараты впервые появились в клинической практике с 1950-х годов прошлого века, когда во Франции был синтезирован хлорпромазин, производное фенотиазина. Хотя изначально хлорпромазин разрабатывался в качестве антигистаминового препарата, при его клиническом использовании были выявлены антипсихотические свойства. Хлорпромазин явился моделью для разработки большого количества химически различных соединений для лечения психозов. Однако все препараты первого поколения (за исключением клозапина) вызывали развитие побочных экстрапирамидных симптомов (ЭПС) благодаря выраженному антагонизму к D2-дофаминовым рецепторам. Помимо влияния на психотические симптомы, свойство данных препаратов блокировать D2-дофаминовые рецепторы используется в других областях медицины (например, в качестве противорвотных средств или для лечения некоторых гиперкинетических двигательных расстройств). Блокаторы D2-дофаминовых рецепторов называются типичными антипсихотиками, в отличие от клозапина и других атипичных антипсихотиков, которые в меньшей степени вызывают экстрапирамидные симптомы. [В соответствии с дофаминергической гипотезой А. Карлсона, за которую он в 2000 году был удостоен Нобелевской премии, блокада D2-дофаминовых рецепторов является основным механизмом развития антипсихотического эффекта как классических нейролептиков, так и атипичных антипсихотиков. — Прим. ред.] Свойство классических антипсихотических препаратов вызывать при их применении экстрапирамидную симптоматику привело к появлению термина «нейролептики», так как данные средства буквально вызывали неврологические расстройства. Кроме того, длительное применение классических нейролептиков сопровождается высоким риском развития поздней дискинезии. Даже при краткосрочном применении типичные антипсихотические препараты могут вызывать симптомы паркинсонизма, а также другие нейролептические побочные симптомы (например, акатизию или акинезию), способные сами по себе симулировать или усиливать психотические симптомы, для лечения которых эти лекарства были первоначально назначены. Более чем за 40 лет клинического применения типичные антипсихотические средства показали свою эффективность при лечении психотических расстройств, но развитие серьезных двигательных нарушений служило значительным ограничением при их использовании.
Появление в последние годы новой группы антипсихотических препаратов, обладающих значительно меньшей способностью вызывать экстрапирамидные симптомы (ЭПС), так называемых атипичных антипсихотиков, открыло новый этап в лечении психотических расстройств. Первым из атипичных антипсихотиков был синтезирован клозапин — препарат, обладающий минимальной способностью вызывать экстрапирамидные расстройства и при этом доказавший свою эффективность при лечении шизофрении. Однако длительное время его применение было ограничено вследствие риска развития агранулоцитоза, требующего еженедельного контроля лейкоцитарной формулы. Кроме того, клозапин вызывает и другие побочные симптомы (седация, увеличение массы тела и снижение порога судорожной активности). Однако эффективность клозапина у многих больных шизофренией с недостаточным терапевтическим эффектом других антипсихотиков перевешивает риск развития побочных явлений. Новые препараты — рисперидон, оланзапин, кветиапин и зипразидон — показали свою эффективность при лечении шизофрении и других психозов, а также мании. Эти препараты в меньшей степени вызывают экстрапирамидные расстройства и в целом имеют более благоприятный профиль побочных симптомов по сравнению с клозапином. В частности, у них отсутствует риск развития агранулоцитоза. Вследствие этого они быстро стали препаратами выбора при лечении психотических расстройств. В контролируемых клинических исследованиях длительностью от 4 до 20 недель новые антипсихотические средства показали равную эффективность с классическими антипсихотиками, хотя и не удалось получить столь же убедительных данных, как для клозапина, об их эффективности у терапевтически резистентных больных.
Высокий аффинитет к D2-дофаминовым рецепторам среди типичных антипсихотиков четко коррелирует с их способностью вызывать экстрапирамидные симптомы. Меньшая способность новых антипсихотических препаратов вызывать ЭПС может быть связана с различными механизмами и пока полностью не изучена. Атипичный антипсихотик рисперидон обладает высоким аффинитетом к D2-рецепторам, сходным с галоперидолом (табл. 2.1), но его высокий аффинитет к серотониновым рецепторам (5-HT2А), возможно, уменьшает частоту развития ЭПС при использовании его в низких дозах (<6 мг/сут). Атипичный антипсихотик кветиапин обладает более низким аффинитетом к 5-HT2А-рецепторам, чем галоперидол, но при этом он также показывает более низкое сродство и к D2-дофаминовым рецепторам. Клозапин обладает относительно низким аффинитетом к D2-рецепторам и высоким к 5-HT2А-рецепторам, но взаимодействует также с большим количеством других рецепторов (см. табл. 2.1), так что основа его эффективности и профиля побочных эффектов до конца остается неясной. [Оланзапин по сравнению с рисперидоном и галоперидолом обладает меньшим сродством к D2-рецепторам и выраженным аффинитетом в отношении 5-HT2А-рецепторов. — Прим. ред.]
Таблица 2.1. Аффинитет к различным рецепторам у атипичных антипсихотиков в сравнении с галоперидолом
| D1 | D2 | D3 | D4 | 5-HT2А | 5-HT2С | α1 | H1 | ACh | |
| Галоперидол | 210 | 1 | 2 | 3 | 45 | >10 000 | 6 | 440 | 5500 |
| Клозапин | 85 | 160 | 170 | 50 | 16 | 10 | 7 | 1 | 2 |
| Оланзапин | 31 | 44 | 50 | 50 | 5 | 11 | 19 | 3 | 2 |
| Кветиапин | 460 | 580 | 940 | 1900 | 300 | 5100 | 7 | 11 | >1000 |
| Рисперидон | 430 | 2 | 10 | 10 | 0,5 | 25 | 1 | 20 | >1000 |
| Зипразидон | 525 | 4 | 7 | 32 | 0,4 | 1 | 10 | 50 | >1000 |
Аффинитет (константы диссоциации) выражен в наномолях. Чем меньше число, тем выше аффинитет (т. е. более низкая концентрация необходима для полунасыщения рецептора). Переиздано с разрешения: Tamminga С.A. Principles of the pharmacotherapy of schizophrenia.. In: Charney D.S., Nestler E.J., Bunney B.S., eds. Neurobiology of mental illness. New York: Oxford University Press, 1999: 274.
Химическая структура
Фенотиазины — исторически первый класс антипсихотических средств — по своей химической структуре представляют собой трициклические молекулы. Все фенотиазины подразделяются на три основных подтипа: алифатические, пиперидиновые и пиперазиновые производные. Фенотиазины с алифатическими боковыми цепями (например, хлорпромазин) в основном являются низкопотентными соединениями (то есть для достижения терапевтического эффекта необходимо использовать более высокие дозы препарата). Пиперидиновые производные обладают антихолинергическими свойствами и в меньшей степени способны вызывать развитие экстрапирамидных расстройств (например, тиоридазин, мезоридазин). Пиперазиновые фенотиазины (например, перфеназин, трифлюоперазин, флуфеназин) являются наиболее мощными антипсихотическими соединениями.
Тиоксантены по химической структуре сходны с фенотиазинами. Бутирофеноны представляют класс чрезвычайно мощных антипсихотических средств. Из них только галоперидол в настоящее время разрешен для использования в психиатрической практике в Соединенных Штатах. Дроперидол — бутирофенон короткого действия — разрешен для использования только в анестезиологической практике. [В последние годы у дроперидола, разрешенного к применению в России также и для купирования психомоторного возбуждения у психически больных, была обнаружена способность удлинять интервал QT, вследствие чего он был снят с производства материнской фирмой производителем. — Прим. ред.]
Несколько соединений различной химической структуры разрешены для лечения психотических и других расстройств в Соединенных Штатах. Пимозид (дифенилбутилпиперазин), разрешенный для лечения синдрома Жиль де ля Туретта, является также и мощным антипсихотическим препаратом с длительным периодом полураспада (несколько дней). Дибензодиазепины, по химической структуре сходные с трициклическими антидепрессантами, имеют центральное кольцо из семи звеньев с замещенным пиперазиновым производным. Этот класс антипсихотических средств представлен типичным антипсихотиком локсапином [Локсапин не разрешен к применению в России. — Прим. ред.], а также атипичным антипсихотиком клозапином.
Рисперидон является производным бензисоксазола и обладает высоким аффинитетом к D2-дофаминовым рецепторам и 5-HT2 серотониновым рецепторам. Оланзапин — производное тиенобензодиазепина имеет большее сродство к серотониновым 5-HT2 рецепторам, чем к дофаминовым рецепторам. По своему профилю связывания с рецепторами мозга оланзапин наиболее сходен с клозапином. Кветиапин является производным дибензоидазепина с низким аффинитетом к серотониновым рецепторам, но еще более низким аффинитетом в отношении дофаминовых рецепторов. Кроме того, у кветиапина отмечается сродство еще к целому ряду других рецепторов.
Механизм действия
Терапевтический механизм действия антипсихотических препаратов понятен только частично. Классические нейролептики (подобные галоперидолу) и атипичные антипсихотики (рисперидон и зипразидон) являются мощными антагонистами D2-дофаминовых рецепторов, а клозапин и кветиапин обладают слабым аффинитетом к D2-рецепторам. Позитронно-эмиссионная томография показывает значительно более низкие уровни блокады D2-рецепторов у этих препаратов в клинически эффективных дозах по сравнению с типичными нейролептиками. Общим свойством атипичных антипсихотических средств является способность блокировать серотониновые 5-HT2А рецепторы. Оланзапин, рисперидон и зипразидон обладают выраженным сродством к данному типу рецепторов. У кветиапина сродство к 5-HT2А рецепторам выражено слабее (см. табл. 2.1). Атипичные антипсихотики взаимодействуют также и с другими подтипами серотониновых рецепторов, но при этом отсутствует единая модель для всех препаратов. Все атипичные антипсихотики, кроме кветиапина, обладают высоким аффинитетом к 5-HT2С рецепторам и все, кроме рисперидона, имеют высокое сродство к 5-HT6 рецепторам. Рисперидон особенно сильно связывается с 5-HT7 рецепторами. Все атипичные антипсихотические препараты взаимодействуют с α1-адренергическими рецепторами и Н1-гистаминовыми рецепторами, что способствует развитию побочных эффектов. Клозапин и оланзапин обладают сильным антихолинергическим действием.
Разнообразие в свойствах связывания с рецепторами у разных антипсихотиков усложняет задачу точного определения механизма действия. Антагонизм к D2-рецепторам четко коррелирует с эффективностью и развитием ЭПС у типичных антипсихотических препаратов. Кроме того, блокада 5-HT2А рецепторов коррелирует с меньшей способностью вызывать экстрапирамидные побочные симптомы. Учитывая, что у клозапина связывание с D4-рецепторами значительно сильнее, чем с D2-рецепторами, появились предположения относительно возможной роли антагонизма к D4-рецепторам в качестве вероятного механизма действия антипсихотических препаратов. Однако относительно селективные D4-антагонисты, так же как и смешанный D4/5-HT2A антагонист фанансерин, не обнаружили антипсихотической активности.
Считается, что блокада D2-рецепторов в мезолимбической и мезокортикальной областях отвечает за терапевтическое действие антипсихотических препаратов, а в нигростриальной области — за развитие ЭПС (рис. 2.1). В области гипоталамуса также существуют дофаминергические проводящие пути и дофамин действует как ингибитор синтеза и высвобождения пролактина из ядер гипофиза. Блокируя дофаминовую передачу в тубероинфундибулярной системе, антипсихотические препараты с сильным антагонизмом к D2-рецепторам могут приводить к развитию гиперпролактинемии. Механизм высокой эффективности клозапина до сих пор остается неизвестным.
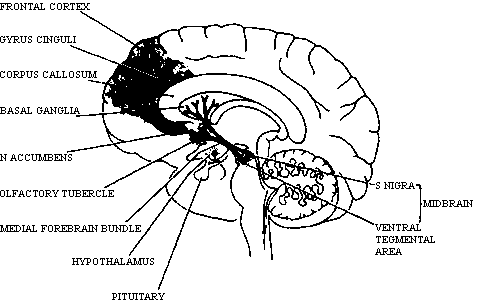
Рис. 2.1. Дофаминовые проводящие пути головного мозга человека. Волокна нервных клеток substantia nigra заканчиваются в базальных ганглиях; волокна нервных клеток покрышки среднего мозга заканчиваются во фронтальной коре и лимбической системе. Волокна дофаминовых клеток гипоталамуса заканчиваются в гипофизе.
Для развития полного терапевтического эффекта при приеме всех антипсихотических препаратов (подобно антидепрессантам) требуется несколько недель. Срок достижения эффекта гораздо больший, чем время, необходимое для блокады рецепторов в ЦНС или для достижения постоянной концентрации препарата в плазме крови. Другими словами, терапевтический эффект антипсихотических средств является вторичным, т. е. обусловлен адаптационными процессами, развивающимися вслед за блокадой рецепторов, и характеризуется более медленным началом и завершением. Поскольку у некоторых больных с первоначальным терапевтическим эффектом рецидивы возникают даже при адекватном содержании антипсихотика в крови, возможно в мозге могут происходить другие типы адаптации, отражающие такие факторы, как изменение самого болезненного процесса, изменение социальных условий жизни больного, появление сопутствующих психических или соматических заболеваний или развитие толерантности к препарату. Нейробиологическая природа отставленных клинических эффектов антипсихотических препаратов остается до конца непонятой, но, вероятно, она связана с изменениями экспрессии генов, синтеза белка и последующей модификацией синаптической передачи.
Кроме воздействия на дофаминовые рецепторы, антипсихотические средства могут вызывать побочные эффекты, связываясь с другими типами рецепторов. Например, низкопотентные типичные антипсихотические препараты являются мощными антагонистами мускариновых рецепторов. Самый высокий аффинитет проявляет тиоридазин, за которым следуют хлорпромазин и мезоридазин. Среди атипичных антипсихотиков клозапин и оланзапин обладают выраженной антихолинергической активностью. Следствием блокады мускариновых рецепторов являются побочные эффекты типа сухости во рту и запоров. Развитие ортостатической гипотензии связано с антагонизмом к α1-адренергическим рецепторам. Выраженным сродством к данному типу рецепторов обладают все атипичные антипсихотики, а среди классических препаратов — мезоридазин, хлорпромазин и тиоридазин. Седативный эффект связан с антагонизмом к нескольким типам рецепторов, включая α1-адренергические, мускариновые и Н1-гистаминовые рецепторы. Вследствие выраженного сродства к этим типам рецепторов низкопотентные антипсихотические препараты типа хлорпромазина и тиоридазина, а также все атипичные антипсихотики могут оказывать седативный эффект (особенно клозапин и кветиапин). Помимо этого, многие антипсихотики блокируют кальциевые каналы нейронов, сердечной мышцы и гладкой мускулатуры.
Применение антипсихотических препаратов во время беременности и лактации
Антипсихотические препараты, как правило, способны проникать через гематоэнцефалический и плацентарный барьеры и попадать в плод и в амниотическую жидкость. Наиболее тщательно изучено применение при беременности хлорпромазина, хотя также исследовалась и тератогенность других препаратов. Четких признаков тератогенности выявлено не было. Однако, учитывая относительный недостаток данных, применения антипсихотических препаратов при беременности, особенно в первом триместре, лучше избегать. Тем не менее, существует множество ситуаций, при которых отсутствие лечения матери создает больший риск для плода, чем любой из нейролептиков. В этом случае требуется тщательная клиническая оценка состояния. В некоторых сообщениях и обзорах указывается на то, что беременная женщина и плод хорошо переносили лечение традиционными нейролептиками, клозапином и атипичными антипсихотиками.
Собрано много данных о проблемах, возникающих при назначении нейролептиков на поздних сроках беременности. Хлорпромазин увеличивает риск развития желтухи новорожденных. Кроме того, существуют сообщения о том, что у матерей, лечившихся антипсихотическими препаратами, рождаются дети с признаками ЭПС. Период полувыведения антипсихотиков у плода составляет как минимум 7-10 дней. Чтобы избежать появления у новорожденного ЭПС, рекомендуется отменить нейролептики у матери за 2 недели до предполагаемой даты родов. Если отмена препарата несет серьезный риск возобновления психоза у матери, врачу следует более тщательно взвесить все за и против продолжения нейролептической терапии.
Антипсихотики выделяются с грудным молоком, хотя, вероятно, в очень низких дозах. Поэтому младенец, находящийся на грудном вскармливании, имеет некоторый риск развития ЭПС. Поскольку влияние антипсихотических препаратов на развитие ребенка неизвестно, матери, нуждающиеся в антипсихотической терапии, должны тщательно рассмотреть альтернативу грудному вскармливанию.
Применение у пожилых
У пожилых пациентов замедлен печеночный метаболизм антипсихотических препаратов (фармакокинетические эффекты), а также увеличена чувствительность рецепторов мозга (фармакодинамические эффекты). Поэтому необходимо использовать более низкие дозировки и выдерживать более длительный период перед увеличением дозы. При применении типичных нейролептиков следует помнить о том, что высокопотентные препараты с меньшей вероятностью, чем низкопотентные, вызывают такие антихолинергические симптомы, как запоры, задержка мочи, тахикардия, седация, спутанность сознания или ортостатическая гипотензия. К сожалению, при приеме мощных нейролептиков у пожилых лиц повышается вероятность развития лекарственного паркинсонизма, а также увеличивается риск развития поздней дискинезии. Клозапин у пожилых пациентов чаще вызывает развитие агранулоцитоза. В связи с этим необходимо назначать более низкие дозы препаратов. У пожилых больных адекватными часто являются дозировки, эквивалентные 0,5-2 мг галоперидола в сутки. Препаратами первого выбора являются, конечно, атипичные антипсихотики, исключая пациентов, длительно получающих терапию типичными нейролептиками (при хорошей переносимости), и пациентов, попытка лечения которых атипичными антипсихотиками оказалась неудачной.
Побочные эффекты и токсичность
Неврологические побочные эффекты
Острая дистония
Клинические проявления. Острая дистония наиболее часто встречается в течение первой недели лечения типичными нейролептиками. Продолжающееся применение по неотложным показаниям парентеральных форм мощных типичных нейролептиков диктует необходимость хорошо распознавать и лечить острую дистонию. Риск ее возникновения выше у больных моложе 40 лет, мужского пола, а также у пациентов, получающих высокопотентные типичные нейролептики (галоперидол, флуфеназин). У больных развивается острая мышечная ригидность и спазмы, обычно в мышцах шеи, языка, лица и спины. Иногда пациент отмечает подострое (в течение 4-6 часов) появление «утолщения» языка или затруднения при глотании. Могут также наблюдаться опистотонус и окулогирные кризы. Острая дистония создает выраженный дискомфорт и пугает пациентов. Иногда развиваются тяжелые осложнения: мышечные спазмы бывают настолько выраженными, что могут вызывать вывихи суставов. Наиболее опасным осложнением является дистония мышц гортани, которая может создавать препятствия току воздуха.
Лечение. Быстрое облегчение обычно приносят антихолинергические препараты (см. табл. 2.6), такие как бензтропин [Бензтропин в России не зарегистрирован и может быть заменен тригексифенидилом (циклодол) или бипериденом (акинетон). При острых дистониях (экситомоторном кризе) особенно эффективно парентеральное введение акинетона. — Прим. ред.] (2 мг в/м или в/в) или дифенилгидрамин (димедрол) (50 мг в/м или в/в). Бензтропин может быть более предпочтителен вследствие того, что у него отсутствуют антигистаминовые эффекты. Если в течение 20 минут эффекта не отмечается, показана повторная инъекция. Если дистония не купируется после двух инъекций, можно попытаться применить бензодиазепин (например, лоразепам в дозе 1 мг в/м или в/в). В случае дистонии гортани с затруднением дыхания повторные дозировки следует проводить с укороченными интервалами до купирования дистонии. Пациент должен получить 4 мг бензтропина внутривенно в течение 10 минут, а затем, при необходимости, 1-2 мг лоразепама внутривенно медленно.
При рецидиве дистонии на фоне продолжающейся антипсихотической терапии рекомендуется вводить фиксированную дозу антихолинергического препарата (например, 2 мг бензтропина 2 раза в сутки) в течение 2 недель (табл. 2.6). Существуют данные о том, что профилактическое применение бензтропина в дозе 2 мг 2 раза в сутки, начатое одновременно с антипсихотической терапией, значительно снижает риск развития дистонии. При приеме низкопотентных препаратов дистония возникает существенно реже, чем при приеме высокопотентных.
Таблица 2.6. Наиболее часто используемые антипаркинсонические препараты**
| Препараты | Диапазон используемых дозировок |
| Антихолинергические препараты | |
| Бензтропин (Когентин)* | 1-2 мг 2 раза в сутки |
| Бипериден (Акинетон) | 1-3 мг 2 раза в сутки |
| Тригексифенидил (Артан, Тремил, Паркопан, Циклодол) | 1-3 мг 3 раза в сутки |
| Антихолинергические антигистаминные | |
| Дифенилгидрамин (Бенадрил, Димедрол) | 25 мг 2-4 раза в сутки, 50 мг 2 раза в сутки |
| Стимуляторы высвобождения дофамина | |
| Амантадин (Симметрел) | 100 мг 2-3 раза в сутки |
* — Препарат в России не зарегистрирован. — Прим. ред.
** — В Европе и отечественной психиатрии распространен также термин корректоры нейролептической терапии. — Прим. ред.
Паркинсонизм, вызванный применением антипсихотических препаратов
Клинические проявления. Симптоматика лекарственного паркинсонизма включает в себя брадикинезию, ригидность, симптом зубчатого колеса, тремор, маскообразное лицо, сгорбленную позу, семенящую походку и слюнотечение. Если эти симптомы достигают выраженной степени, может развиваться акинезия, неотличимая от кататонии. Данный синдром появляется, как правило, после нескольких недель терапии и наиболее часто встречается у пожилых, а также у пациентов, принимающих высокопотентные нейролептики. Лекарственный паркинсонизм редко встречается в ходе терапии атипичными антипсихотиками, за исключением рисперидона в дозах 8 мг и выше, и практически не встречается при приеме клозапина, оланзапина и кветиапина.
Если лекарственный паркинсонизм развивается у больного в ремиссии, целесообразен перевод с типичного на атипичный антипсихотик. При переводе на атипичный антипсихотик необходимо убедиться в том, что, помимо исчезновения симптомов паркинсонизма, новый препарат сопоставим с предыдущим по эффективности.
Лечение. Если доза антипсихотического препарата не менялась, то следует назначить фиксированную дозировку корректора и уменьшить дозу нейролептика до минимально эффективной. У пожилых больных должны использоваться более низкие дозы антипаркинсонических средств (например, 1 мг бензтропина 2 раза в сутки). В некоторых случаях может помочь переход на низкопотентные нейролептики (особенно тиоридазин), но предпочтителен перевод пациента на атипичные антипсихотики. Учитывая, что длительное использование антихолинергических средств увеличивает риск поздней дискинезии, в ходе поддерживающей терапии следует периодически делать попытки их отменить.
Акатизия
Клинические проявления. Акатизия субъективно переживается как интенсивное неприятное ощущение неусидчивости, необходимости двигаться, особенно выраженное в нижних конечностях. Пациент часто выглядит беспокойным, испытывая симптомы тревоги или возбуждения. Акатизию следует дифференцировать с тревогой, связанной с психотическим расстройством. При усилении неусидчивости в течение терапии типичными нейролептиками всегда следует помнить о возможности развития акатизии. Недавние исследования убеждают в том, что акатизия при применении типичных нейролептиков встречается чаще, чем это считалось ранее. Акатизия представляет собой главную причину несоблюдения больными режима лекарственной терапии и отказа от терапии. Постоянный дискомфорт может усиливать у пациента чувство безнадежности и является одной из причин появления суицидальных мыслей. Как и паркинсонизм, акатизия маловероятна при приеме рисперидона в малых дозах, редко встречается на фоне терапии оланзапином и кветиапином и практически отсутствует при приеме клозапина.
Лечение. Типичные нейролептики всегда следует назначать в минимально эффективной дозе. Низкопотентные типичные нейролептики, особенно тиоридазин, имеют значительно меньший риск развития акатизии, чем высокопотентные препараты. Свою эффективность при лечении акатизии доказали многие препараты, включая β-адреноблокаторы (как средство первого выбора), антихолинергические средства и бензодиазепины. Существуют отдельные сообщения о применении клонидина при акатизии, но следует помнить, что клонидин вызывает артериальную гипотензию.
При лечении акатизии могут возникать различные ситуации, требующие дифференцированного подхода. Мы рекомендуем следующее:
A. Если больной лечится высокопотентным типичным нейролептиком и у него отсутствуют другие ЭПС.
1. Препарат 1-го выбора: β-адреноблокатор, например пропранолол в дозе 10-30 мг 3 раза в сутки (также можно использовать надолол) (см. главу 6).
2. Препарат 2-го выбора: антихолинергические средства, такие как бензтропин в дозе 2 мг 2 раза в сутки.
3. Препарат 3-го выбора: бензодиазепин, например лоразепам в дозе 1 мг 3 раза в сутки или клоназепам в дозе 0,5 мг 2 раза в сутки.
B. Если больной принимает низкопотентные типичные нейролептики (например, тиоридазин) или антипсихотический препарат в комбинации с трициклическим антидепрессантом и у него отсутствуют другие ЭПС.
1. Препарат 1-го выбора: пропранолол — 10-30 мг 3 раза в сутки.
2. Препарат 2-го выбора: лоразепам — 1 мг 3 раза в сутки или клоназепам — 0,5 мг 2 раза в сутки.
3. Препарат 3-го выбора: бензтропин — 1 мг 2 раза в сутки (возможно усиление антихолинергической токсичности).
C. Если у больного, принимающего антипсихотические средства, обнаруживаются другие ЭПС (дистония или паркинсонизм).
1. Препарат 1-го выбора: бензтропин — 2 мг 2 раза в сутки.
2. Препарат 2-го выбора: бензтропин в комбинации с пропранололом в дозе 10-30 мг 3 раза в сутки.
3. Препарат 3-го выбора: бензтропин с лоразепамом в дозе 1 мг 3 раза в сутки или клоназепамом в дозе 0,5 мг 2 раза в сутки.
D. Если у больного присутствуют другие ЭПС; при этом акатизия не реагирует на монотерапию антихолинергическими средствами.
1. Препараты 1-го выбора: бензтропин — 2 мг 2 раза в сутки с пропранололом — 10-30 мг 3 раза в сутки.
2. Препараты 2-го выбора: бензтропин — 2 мг 2 раза в сутки с лоразепамом — 1 мг 3 раза в сутки или клоназепамом — 0,5 мг 2 раза в сутки.
E. Если у больного присутствуют ЭПС или акатизия, врач должен рассмотреть возможность перевода пациента на атипичный антипсихотик, учитывая, что новый препарат не всегда оказывается столь же эффективным, как предшествующий.
Злокачественный нейролептический синдром (ЗНС)
Клинические проявления. ЗНС представляет собой крайне тяжелую идиосинкразическую реакцию на прием нейролептических препаратов. Основные симптомы ЗНС включают: ригидность, лихорадку, вегетативные нарушения и делириозные проявления. Симптоматика развивается, как правило, в течение нескольких часов или дней, причем появление ригидности обычно предшествует подъему температуры и вегетативным нарушениям. Температура тела может подниматься до 41 ˚C и выше. Типична разлитая мышечная скованность по типу «свинцовой трубы», которая в некоторых случаях вызывает мионекроз. Развитие дегидратации, приводящей к миоглобинурии, может вызвать почечную недостаточность. Вегетативные нарушения включают нестабильность артериального давления (часто как гипер-, так и гипотензию), тахикардию, диарею и бледность кожи и слизистых. Могут отмечаться нарушения сердечного ритма. Помимо ригидности, мышечные расстройства проявляются в виде акинезии, тремора (выраженность которого может колебаться) и непроизвольных телодвижений. Как правило, у пациентов отмечается спутанность сознания и мутизм. Психомоторные нарушения наблюдаются в диапазоне от ажитации до ступора. Могут развиваться также судорожные припадки и кома.
Злокачественный нейролептический синдром — это клинический диагноз с относительно широким диапазоном степеней тяжести. Вследствие того что критерии тяжести неясны, сложно установить степень поражения, особенно в легких случаях. Хотя не существует специфических лабораторных маркеров, обычно повышен уровень креатинфосфокиназы (КФК). Также отмечается нарушение функциональных печеночных проб, включая повышение трансаминаз и лактатдегидрогеназы. Может наблюдаться лейкоцитоз.
Факторы риска развития ЗНС включают в себя дегидратацию, недостаточное питание, внешнее тепловое воздействие, и, возможно, интеркуррентные соматические заболевания. ЗНС могут вызывать все типичные нейролептики, но большие дозы высокопотентных нейролептиков увеличивают риск. Хотя ЗНС крайне редко развивается на фоне приема атипичных антипсихотиков, описан ряд случаев развития синдрома при приеме рисперидона, что, вероятно, отражает сильное дофамин-блокирующее действие препарата и использование чрезмерных дозировок.
При терапии тяжелых психозов часто возникает вопрос: «Может ли пациент после перенесенного ЗНС снова получать типичные нейролептики?». Не у всех больных, перенесших ЗНС, синдром развивается повторно, даже при использовании препарата, его вызвавшего. Тем не менее накапливающиеся в литературе данные указывают на то, что рецидив развивается у значительной части пациентов, однажды перенесших ЗНС. Учитывая тяжелое течение и возможность летального исхода, целесообразно воздерживаться от назначения типичных нейролептиков пациентам, перенесшим ЗНС, если только не имеется абсолютных показаний для продолжения такого лечения и не существует альтернативы. Мы считаем, что всем пациентам с высоким риском развития рецидива ЗНС следует назначать атипичные антипсихотики. Если по каким-то причинам это невозможно, то в качестве альтернативы можно использовать минимальные дозы низкопотентных препаратов, таких как тиоридазин. В идеале не следует возобновлять антипсихотическую терапию в течение как минимум 4 недель после полного исчезновения симптомов ЗНС. Следует подробно обсудить все преимущества и недостатки подобного решения с пациентом и его родственниками.
Лечение. Необходим тщательный уход за больным, включающий поддержание водно-солевого баланса, применение охлаждающих обертываний при высокой температуре, переворачивание пациента для профилактики пролежней, контроль сердечной деятельности, а также контроль выделения мочи и почечной функции. При развитии почечной недостаточности необходим гемодиализ. Однако не следует ожидать, что гемодиализ поможет вывести из организма нейролептики, так как они прочно связываются с белками плазмы и периферическими тканями. Дантролен, миорелаксант прямого действия, может быстро уменьшить мышечную ригидность, вторичную гипертермию и тахикардию. Дозировки дантролена четко не установлены, но рекомендуемые дозы обычно колеблются в диапазоне от 0,8 до 10,0 мг/кг в сутки. В целом эффективными представляются дозы 1-3 мг/кг в сутки перорально или внутривенно, разделенные на 4 приема. Дозировки свыше 10 мг/кг в сутки обладают гепатотоксичностью. Считается, что агонист дофамина бромокриптин также способен уменьшать некоторые симптомы ЗНС за счет центрального действия. Существуют противоречивые мнения по вопросу о том, способен ли бромокриптин ускорять выздоровление. Эффект препарата развивается обычно через несколько дней терапии. Лечение бромокриптином начинают, как правило, с пероральной дозы 2,5 мг 3 раза в сутки, а затем по мере переносимости дозировку увеличивают до 5-10 мг 3 раза в сутки перорально. Дантролен и бромокриптин можно назначать вместе. Длительность терапии каждым из этих препаратов четко не установлена, но целесообразно продолжать терапию в течение недели после исчезновения симптомов ЗНС. В случаях тотальной ригидности мышц с угрожающей жизни гипертермией спасти пациента могут наркоз и общая миорелаксация.
Поздняя дискинезия
Поздняя дискинезия (ПД) представляет собой синдром длительно сохраняющихся или постоянных аномальных непроизвольных движений. Наиболее часто поздняя дискинезия вызывается длительным приемом типичных нейролептиков (около 20% больных). Клинически поздняя дискинезия проявляется в виде непроизвольных движений языка, мышц лица и шеи, верхних и нижних конечностей, мышц тела или, иногда, мышечных групп, способствующих актам дыхания и глотания. Вначале обычно появляются движения щечно-язычных и жевательных мышц в виде «толкания» языка (часто доступное наблюдению как выталкивание языка через щеки или губы), высовывания языка, чмоканья губами, сжатия губ, жевательных движений и надувания щек. На начальных этапах ПД могут отмечаться чрезмерные бесцельные движения лицевых мышц, включая гримасничанье, моргание и быстрые, подобные тику, движения лицевых или периорбитальных мышц. Хотя эти движения иногда бывает тяжело отличить от стереотипных поз, возникающих спонтанно у хронически больных психозами, симптомы ПД в целом кажутся менее произвольными и носят больше хореоатетоидный характер.
ПД редко появляется у пациентов, принимающих нейролептики меньше 3-6 месяцев. Существует лишь один твердо установленный фактор риска развития ПД — это применение типичных нейролептиков у лиц старше 50 лет. Некоторые данные указывают на то, что у женщин, по сравнению с мужчинами, риск ПД выше. Имеются противоречивые данные о том, что у пациентов с аффективными расстройствами риск развития ПД выше. Прерывистый режим приема нейролептиков (особенно у больных с аффективными расстройствами) также повышает риск развития ПД. Нет достоверных сведений, что тот или иной из типичных нейролептиков чаще или реже других вызывает ПД. Нет также четкой корреляции между развитием паркинсонизма в ходе лечения нейролептиками и риском ПД. Имеются данные, что хроническое использование антихолинергических средств может увеличивать риск ПД. Поэтому их использование, по возможности, нужно сводить к минимуму.
С появлением атипичных нейролептиков, принимая решение о продолжении лечения пациентов, получающих типичные нейролептики и имеющих риск развития ПД, врач должен учитывать множество факторов. Выбор может зависеть от клинической ситуации. Встречаются пациенты, у которых отмечается очень хороший эффект нейролептиков без развития поздней дискинезии; пациенты с хорошим эффектом и минимально выраженной ПД; пациенты с хорошим эффектом и умеренной или тяжелой ПД; пациенты с недостаточным эффектом и минимально выраженной ПД и, наконец, пациенты с плохим эффектом и тяжелой ПД. Исключая группу пациентов с хорошим антипсихотическим эффектом и отсутствием ПД, все остальные варианты требуют рассмотрения вопроса о переводе больного на терапию атипичными антипсихотиками. Первый курс терапии всем пациентам, особенно имеющим высокий риск развития ПД (пожилые больные и другие группы риска) или с наличием ПД в анамнезе, следует проводить атипичными антипсихотиками. Мы считаем, что необходимо переводить с типичных на атипичные антипсихотики даже тех больных, у которых отмечается хороший антипсихотический эффект при отсутствии ПД. Конечно, перед изменением терапии у пациентов, имеющих риск причинения вреда себе или окружающим, всегда следует проводить тщательную клиническую оценку состояния.
ПД часто возникает в то время, когда пациент еще принимает антипсихотик. Однако антипсихотические препараты могут маскировать симптомы ПД и аномальные непроизвольные движения становятся очевидными лишь после отмены или снижения дозы препарата. Когда спустя несколько дней или недель подобные симптомы исчезают, они расцениваются как дискинезия отмены. Если они приобретают стойкий характер, то определяются как ПД. Хотя не существует надежных данных, подтверждающих, что дискинезия отмены предвещает появление ПД при продолжении терапии нейролептиками, при ее появлении целесообразно прекратить лечение традиционными нейролептиками и назначить атипичные антипсихотики.
В литературе существуют противоречивые данные относительно прогноза течения ПД у больных, продолжающих принимать типичные нейролептики. В некоторых исследованиях было обнаружено прогрессирование ПД; другие наблюдали, что, развившись, симптомы ПД могут достигать фазы плато или в некоторых случаях уменьшаться.
Поздняя дистония, синдром отставленной рефрактерной дистонии, редко отмечается у больных шизофренией, длительно получающих типичные нейролептики. Его клинические проявления могут перекрывать картину ПД. Его истинная природа и факторы риска изучены плохо.
Профилактика. Надежного лечения ПД не существует. Поэтому наиболее оптимальным подходом является предотвращение ее развития путем ограничения использования типичных нейролептиков лишь теми ситуациями, когда они действительно показаны. В частности, пациенты с аффективными нарушениями, тревожными или личностными расстройствами не должны принимать типичные нейролептики в течение длительного периода времени, если не имеется абсолютных доказательств того, что клиническая польза перевешивает потенциальный риск развития ПД. В связи с высоким риском развития ПД целесообразно также избегать длительного применения типичных нейролептиков при лечении больных с задержкой умственного развития, органическими синдромами, а также у пожилых лиц.
Перед началом антипсихотической терапии врач всегда должен тщательно обследовать больного. Лучше всего использовать стандартизированную шкалу аномальных движений, такую как Шкала аномальных непроизвольных движений (AIMS), изданную Национальным институтом психического здоровья. Данное обследование необходимо повторять не реже чем раз в 6 месяцев, по ходу антипсихотической терапии. Если лечение нейролептиками должно продолжаться год, то врачу следует попытаться снизить дозу или отменить препарат и проводить оценку после снижения дозы или во время паузы в приеме препарата. Если обнаружены данные в пользу развития ПД, врач должен обсудить осложнения с пациентом и его семьей, чтобы получить информированное согласие в отношении продолжения антипсихотической терапии или перехода на атипичный антипсихотик.
Дифференциальный диагноз. Существует множество первичных неврологических расстройств, сходных с ПД (табл. 2.7).
Таблица 2.7 Дифференциальная диагностика поздней дискинезии
Неврологические расстройства
Болезнь Вильсона (Wilson)
Болезнь Гентингтона (Huntington)
Новообразования мозга
Синдром Фара (Fahr)
Идиопатические дистонии (включая блефароспазм, мандибулярную дистонию, лицевые тики)
Синдром Мейжа (Meige) (спонтанные оральные дискинезии)
Торсионная дистония (семейное расстройство без психических симптомов)
Постгипоксические или постэнцефалитические экстрапирамидные симптомы
Лекарственные средства и токсины
Антидепрессанты
Литий
Антихолинергические средства
Фенитоин
L-допа и агонисты дофамина
Амфетамины и родственные им стимуляторы
Магний и другие тяжелые металлы
Лечение. Хотя существует множество терапевтических стратегий, включающих применение лития, лецитина, физостигмина или бензодиазепинов, эффективного лечения ПД не существует. Ранее указывалось на то, что профилактика витамином E может предотвратить развитие или ухудшение поздней дискинезии, но последующие исследования были менее обнадеживающими.
Кардиотоксичность
Пимозид и низкопотентные нейролептики — тиоридазин и мезоридазин могут замедлять сердечную проводимость. Они являются мягкими антиаритмиками, но могут и создавать проблемы, включающие сердечную блокаду и удлинение интервала QT с риском развития трепетания-мерцания желудочков. Хотя токсичность этих препаратов, вероятнее всего, проявляется при передозировке, она может возникать и при терапевтических дозах. Поэтому пациенты с установленным диагнозом сердечной патологии должны получать высокопотентные типичные нейролептики или атипичные антипсихотики. Сертиндол, перспективный атипичный антипсихотик, в конечном счете не был зарегистрирован на рынке вследствие мнения о том, что он способен вызывать удлинение интервала QT. Рисперидон также в некоторых случаях может вызывать удлинение интервала QT. Имелась некоторая неопределенность об удлинении интервала QT при использовании зипразидона. В дополнительных исследованиях не было зарегистрировано значимых отклонений ЭКГ. У больных с подъемом QT в ходе терапии этими препаратами следует проводить ЭКГ-мониторинг.
Известно, что клозапин способен вызывать тахикардию, не связанную с ортостатической гипотензией. У пациентов, принимающих низкопотентные нейролептики, на ЭКГ может отмечаться удлинение интервалов QT и PR, депрессия сегмента ST и учащение сердечного ритма, имеющее незначительные клинические последствия, исключая больных с исходной сердечной патологией или предшествующей сердечной блокадой. Удлинение интервала QT в этих случаях диктует необходимость замены терапии на высокопотентный (например, галоперидол) нейролептик или атипичный антипсихотик.
Ортостатическая гипотензия
Ортостатическая гипотензия наиболее часто развивается при использовании типичных низкопотентных нейролептиков, таких как хлорпромазин и тиоридазин, а также при приеме клозапина. Однако высокопотентный атипичный антипсихотик рисперидон, как и другие атипичные препараты, также вызывает ортостатическую гипотензию, которая развивается вследствие блокады α-адренергических рецепторов и может приводить к рефлекторной тахикардии. Ортостатическая гипотензия бывает разной степени тяжести, вплоть до развития синкопальных состояний. Проявления гипотензии практически всегда уменьшаются в положении лежа на спине. Поэтому пациента следует предупредить о необходимости медленно подниматься из положения лежа.
Увеличение веса
Увеличение веса могут вызывать как типичные, так и атипичные антипсихотики. Из всех антипсихотических средств подобным побочным эффектом не обладает только молиндон. [Молиндон (мобан) не зарегистрирован в России. — Прим. ред.] Среди атипичных антипсихотиков наиболее выраженное увеличение веса вызывают клозапин и близкий к нему по химической структуре оланзапин. Кветиапин и рисперидон также могут приводить к увеличению веса тела. Считается, что у зипразидона данный побочный эффект выражен минимально. Учитывая необходимость длительного применения антипсихотиков, увеличение веса является не просто косметическим дефектом. Во-первых, появление избыточного веса может ухудшить соблюдение больным режима терапии. Во-вторых, избыточный вес повышает риск развития сердечной патологии, гипертензии и диабета. Случаи появления диабета II типа описаны при приеме оланзапина. Невозможно точно предсказать степень увеличения веса для каждого конкретного больного, принимающего клозапин, оланзапин или другие препараты (в некоторых исследованиях указывается на то, что данный побочный эффект развивается у 40% больных, принимающих клозапин). Во избежание чрезмерной прибавки веса пациента необходимо информировать о подобном риске и рекомендовать ему диету и физические упражнения. Если во время приема препарата отмечается увеличение веса, то показаны изменение терапии и переход на другой антипсихотик с менее выраженным влиянием на массу тела.
Глазные побочные эффекты
Нечеткое зрение
В результате того, что низкопотентные антипсихотики, такие как хлорпромазин, тиоридазин, мезоридазин и клозапин обладают антихолинергическим эффектом, они могут вызывать циклоплегию (нарушение аккомодации). Пациенты жалуются на нечеткое зрение, особенно выраженное при чтении. Этот симптом вызывают иногда и нейролептики средней мощности (например, перфеназин). Кроме того, нечеткое зрение может развиваться при приеме антихолинергических средств, назначаемых для лечения ЭПС. С данной проблемой часто позволяют справиться очки для чтения.
Глаукома
Любые антихолинергические средства могут провоцировать приступ закрытоугольной глаукомы. Поэтому при наличии глаукомы в анамнезе следует использовать высокопотентные антипсихотики, лишенные холинолитических свойств. Помимо этого, необходимо осуществлять постоянный офтальмологический контроль и избегать назначения антипаркинсонических средств. Закрытоугольная глаукома является неотложным медицинским состоянием. Пациенты с открытоугольной глаукомой могут получать нейролептическую терапию при условии сопутствующего лечения глаукомы у офтальмолога.
Пигментация тканей глаза
Данный побочный эффект можно разделить на две категории. Первая категория представлена пигментацией хрусталика, роговицы, конъюнктивы и сетчатой оболочки глаза (часто сопровождается пигментацией кожи). Этот тип пигментации развивается, главным образом, при использовании низкопотентных нейролептиков и редко нарушает зрение, за исключением крайне тяжелых случаев. Вторая категория представляет собой пигментную ретинопатию, связанную с приемом тиоридазина в дозах свыше 800 мг в сутки, и ведет к необратимым дегенеративным изменениям с нарушением зрения. По этой причине никогда не следует назначать тиоридазин в дозах, превышающих 800 мг в сутки. Если пациенты, принимающие тиоридазин, предъявляют жалобы на нарушение зрения, то им показана консультация офтальмолога.
Кожные побочные эффекты
Подобно препаратам любых других классов, антипсихотические средства могут вызывать кожные аллергические высыпания, возникающие, как правило, в ходе первых 2 месяцев терапии. Наиболее часто сыпь проявляется в виде макуло-папулезных эритематозных пятен, располагающихся на верхней части туловища, лице, шее и конечностях. Хотя сыпь обычно носит умеренный характер, описаны случаи эксфолиативного дерматита. Прекращение лечения приводит к редукции этих симптомов. Если сохраняется необходимость в дальнейшей антипсихотической терапии, следует выбрать препарат другого химического класса.
Низкопотентные типичные нейролептики могут действовать как фотосенсибилизаторы, приводя к тяжелым солнечным ожогам. Кроме того, существуют немногочисленные сообщения о появлении серо-голубого окрашивания кожи, обычно сопровождающегося изменениями пигментации тканей глаза. Хотя этот эффект косметически нежелателен, он не указывает на предрасположенность к кожной патологии в дальнейшем.
Гипоталамические и гипофизарные побочные эффекты
Основным эндокринологическим эффектом рисперидона, равно как и типичных нейролептиков, является гиперпролактинемия. Эти антипсихотические препараты, в отличие от клозапина и других атипичных антипсихотиков, блокируют нормальную тоническую дофаминергическую ингибицию пролактина. У женщин это может привести к галакторее (редко встречается у мужчин) и аменорее. У мужчин гиперпролактинемия может вызвать импотенцию. Слабое влияние клозапина на уровень пролактина объясняется его низким аффинитетом к D2-рецепторам.
Известно, что у некоторых пациентов антипсихотики вызывают развитие гипертермии и значительное увеличение массы тела. Механизм, лежащий в основе данных симптомов, понятен плохо, но предполагают, что он опосредуется через гипоталамус. Значительное ожирение, индуцированное приемом нейролептиков, может приводить к отказу больных от приема препарата. Существует несколько сообщений о том, что молиндон реже, чем другие типичные нейролептики, вызывает ожирение. Предполагается, что зипразидон также оказывает минимальное влияние на вес.
Печеночные побочные эффекты
Нейролептики, особенно хлорпромазин, способны вызывать холестатическую желтуху, возможно, вследствие реакции гиперчувствительности у предрасположенных индивидов. В ходе первых двух месяцев терапии желтуха обычно сопровождается тошнотой, недомоганием, лихорадкой, зудом и болями в животе. Отмечается повышение активности щелочной фосфатазы и уровня билирубина, сопровождающееся минимальным повышением активности трансаминаз. При развитии гепатита требуется отмена препарата, после чего желтуха обычно исчезает в течение 2-4 недель. Если показано продолжение антипсихотической терапии, следует выбрать препарат другого химического класса.
Гематологические побочные эффекты
Агранулоцитоз представляет собой гематологический побочный эффект, потенциально опасный для жизни. Наиболее часто он встречается при терапии клозапином и очень редко — при применении алифатических или пиперидиновых производных фенотиазина. Вероятность развития агранулоцитоза при приеме клозапина составляет 1-3%. Как уже упоминалось ранее, обязательный еженедельный контроль количества лейкоцитов необходим в течение всего периода лечения клозапином и несколько недель после его отмены. При снижении числа лейкоцитов на 50% или ниже 3000, необходимо немедленно отменить препарат. Вследствие того, что риск развития лейкопении у пациентов, принимающих клозапин, оказался ниже, чем считалось ранее, спустя 6 месяцев терапии контроль можно проводить 1 раз в 2 недели. Пациентов, получающих другие нейролептики, лучше предупредить о необходимости информирования врача в случае возникновения признаков инфекции (например, боль в горле), чем проводить контроль числа лейкоцитов. При развитии симптоматического агранулоцитоза требуется незамедлительная отмена терапии. Если агранулоцитоз у конкретного пациента связан с приемом нейролептика, этот препарат ему навсегда противопоказан.
Передозировка
Хотя нейролептики имеют много токсических эффектов, ограничивающих их терапевтическое использование, риск смертельного исхода при передозировке невелик. Как правило, наиболее тяжелыми осложнениями передозировки являются кома и гипотония. Оба эти состояния корригируются восполнением объема жидкости. Редко, обычно на фоне приема пимозида, тиоридазина и мезоридазина, развиваются летальные сердечные аритмии. Эти препараты могут удлинять интервал QT и провоцировать развитие сердечной блокады или трепетание-мерцание желудочков.
Проявления передозировки различаются у высоко- и низкопотентных антипсихотиков. Низкопотентные антипсихотики, такие как хлорпромазин и тиоридазин, как правило, вызывают угнетение ЦНС. При приеме 3-4 г хлорпромазина может развиться кома. Низкопотентные антипсихотики при передозировке могут снижать судорожный порог; тиоридазин также обладает потенциальными антихолинергическими свойствами. Кроме того, эти препараты обладают α-адреноблокирующим эффектом и, следовательно, их прием может сопровождаться выраженной гипотензией. Как и другие нейролептики, они также способны вызывать гипо- или гипертермию. Нарушения сердечной деятельности возникают нечасто и могут включать удлинение QT и желудочковые тахиаритмии, особенно при приеме тиоридазина.
Высокопотентные антипсихотики вызывают как угнетение, так и возбуждение ЦНС с развитием ажитации, делирия и тяжелых экстрапирамидных нарушений в виде мышечной ригидности, тремора или кататонических симптомов. Может нарушаться терморегуляция и иногда отмечаются сердечные аритмии.
При тяжелых передозировках основу терапии составляет тщательный уход. Психомоторное возбуждение купируется низкими дозами лоразепама. Гипотензия, не проходящая при восполнении объема жидкости, поддается воздействию сосудосуживающих средств, таких как норадреналин или фенилэфрин (phenylephrine). Применения агонистов β-адренорецепторов следует избегать, так как они могут усилить вазодилятацию. Гипотермию следует купировать медленным согреванием. При гипертермии нужно назначать жаропонижающие средства и при необходимости охлаждающие обертывания. Тяжелые экстрапирамидные нарушения купируются введением дифенилгидрамина в дозе 50 мг в/м или в/в или бензтропина в дозе 2 мг в/м или в/в. Для контроля возможного развития сердечной аритмии необходим мониторинг сердечной деятельности.
Желудочковые тахиаритмии можно купировать лидокаином. Электростимуляция сердца применяется при лечении тахиаритмий, угрожающих жизни. Трепетание-мерцание желудочков, которое иногда развивается при передозировке пимозида, тиоридазина или мезоридазина, лучше всего поддается лечению изопротеренолом или электростимуляцией.
Если препарат был принят недавно, следует вызвать рвоту (что может быть затруднительно вследствие противорвотного действия нейролептиков) или удалить содержимое желудка через назогастральный зонд. После завершения процедуры для абсорбции оставшегося препарата следует назначить активированный уголь вместе со слабительным средством. Форсированный диурез и диализ для выведения нейролептиков неэффективны.
