АНТИБИОТИКИ
Глава 37. Антибактериальные химиотерапевтические средства
Антибиотики — это химиотерапевтические вещества биологического происхождения, избирательно угнетающие жизнедеятельность микроорганизмов.
При классификации антибиотиков используют различные принципы.
В зависимости от источников получения, антибиотики разделяются на две группы: природные (биосинтетические), продуцируемые микроорганизмами и низшими грибами, и полусинтетические, получаемые в результате модификации структуры природных антибиотиков.
Интересуетесь фармакологией? Вы фармацевт, провизор или врач? Рекомендуем вам прочитать фармакологические научные журналы. Большая библиотека интересных журналов различных тематик.
По химическому строению выделяют следующие группы антибиотиков:
- Бета-лактамные антибиотики (пенициллины, цефалоспорины, карбапенемы, монобактамы).
- Макролиды и близкие к ним антибиотики.
- Аминогликозиды.
- Тетрациклины.
- Полимиксины.
- Полиены (противогрибковые антибиотики).
- Препараты хлорамфеникола (левомицетина).
- Гликопептидные антибиотики.
- Антибиотики разных химических групп.
Характер (тип) действия антибиотиков может быть бактерицидным (фунги-или протозоацидным, в зависимости от возбудителя), под которым понимается полное разрушение клетки инфекционного агента, и бактериостатическим (фунги-, протозоастатическим), которое проявляется прекращением роста и деления его клеток.
Бактерицидный или бактериостатический характер влияния антибиотиков на микрофлору во многом определяется особенностями механизма их действия. Установлено, что противомикробное действие антибиотиков развивается, в основном, как следствие нарушения:
- синтеза клеточной стенки микроорганизмов;
- проницаемости цитоплазматической мембраны микробной клетки;
- внутриклеточного синтеза белка в микробной клетке;
- синтеза РНК в микроорганизмах.
При сопоставлении характера и механизма действия антибиотиков (табл. 37.1), видно, что бактерицидный эффект оказывают преимущественно те антибиотики, которые нарушают синтез клеточной стенки, изменяют проницаемость цитоплазматической мембраны или нарушают синтез РНК в микроорганизмах. Бактериостатическое действие характерно для антибиотиков, нарушающих внутриклеточный синтез белка.
По спектру антимикробного действия антибиотики можно условно разделить на препараты широкого спектра действия (действующие на грамположительную и грамотрицательную микрофлору: тетрациклины, левомицетин, аминогликозиды, цефалоспорины, полусинтетические пенициллины) и препараты сравнительно
Таблица 37.1. Механизм и характер антимикробного действия антибиотиков
| Механизм действия | Антибиотики | Преимущественный характер антимикробного действия |
| Нарушение синтеза клеточной стенки | β-лактамиды
Гликопептидные антибиотики Циклосерин Бацитрацин |
Бактерицидный
Бактерицидный Бактерицидный |
| Нарушение проницаемости
цитоплазматической мембраны |
Полимиксины
Полиеновые антибиотики |
Бактерицидный
Бактерицидный |
| Нарушение внутриклеточного синтеза белка | Макролиды
Тетрациклины Линкозамиды Левомицетин Аминогликозиды |
Бактериостатический
Бактериостатический Бактериостатический Бактериостатический Бактерицидный |
| Нарушение синтеза РНК | Рифампицин | Бактерицидный |
узкого спектра действия. Вторую группу в свою очередь можно разделить на антибиотики, действующие преимущественно на грамположительную микрофлору (биосинтетические пенициллины, макролиды) и антибиотики, действующие преимущественно на грамотрицательную микрофлору (полимиксины). Кроме того, различают противогрибковые и противоопухолевые антибиотики.
По клиническому применению выделяют основные антибиотики, с которых начинают лечение до определения чувствительности к ним микроорганизмов, вызвавших заболевание, и резервные, которые применяют при устойчивости микроорганизмов к основным антибиотикам или при непереносимости последних.
В процессе применения антибиотиков к ним может развиться устойчивость (резистентность) микроорганизмов, т.е. способность микроорганизмов размножаться в присутствии терапевтической дозы антибиотика. Резистентность микроорганизмов к антибиотикам может быть природной и приобретенной.
Природная устойчивость связана с отсутствием у микроорганизмов «мишени» для действия антибиотика или недоступности «мишени» вследствие низкой проницаемости клеточной стенки, а также ферментативной инактивации антибиотика. При наличии у бактерий природной устойчивости антибиотики клинически неэффективны.
Под приобретенной устойчивостью понимают свойство отдельных штаммов бактерий сохранять жизнеспособность при тех концентрациях антибиотиков, которые подавляют основную часть микробной популяции. Приобретенная устойчивость является либо результатом спонтанных мутаций в генотипе бактериальной клетки, либо связана с передачей плазмид от естественно-устойчивых бактерий к чувствительным видам.
Известны следующие биохимические механизмы устойчивости бактерий к антибиотикам:
- ферментативная инактивация препаратов;
- модификация «мишени» действия антибиотиков;
- активное выведение антибактериальных препаратов из микробной клетки;
- снижение проницаемости клеточной стенки бактерий;
- формирование метаболического «шунта».
Устойчивость микроорганизмов к антибиотикам может иметь групповую специфичность, т.е. не только к применяемому препарату, но и к другим препаратам из той же химической группы. Такая устойчивость называется «перекрестной».
Соблюдение принципов применения химиотерапевтических средств позволяет уменьшить вероятность возникновения устойчивости.
Несмотря на то, что антибиотики характеризуются высокой избирательностью действия, тем не менее они оказывают целый ряд побочных эффектов аллергической и неаллергической природы.
БЕТА-ЛАКТАМНЫЕ АНТИБИОТИКИ
Бета-лактамные антибиотики — это лекарственные средства, имеющие в составе молекулы б-лактамный цикл: пенициллины, цефалоспорины, карбапенемы и монобактамы.

β-лактамный цикл необходим для проявления противомикробной активности этих соединений. При расщеплении β-лактамного цикла бактериальными ферментами (б-лактамазами) антибиотики утрачивают антибактериальное действие.
Все бета-лактамные антибиотики обладают бактерицидным эффектом, в основе которого лежит угнетение ими синтеза клеточной стенки бактерий. Антибиотики этой группы нарушают синтез пептидогликана-биополимера, являющегося основным компонентом клеточной стенки бактерий. Пептидогликан состоит из полисахаридов и полипептидов.
В состав полисахаридов входят аминосахара-ацетилглюкозамин и N-ацетилмурамовая кислота. С аминосахарами связаны короткие пептидные цепи. Окончательную жесткость клеточной стенке придают поперечные пептидные цепочки, состоящие из 5 остатков глицина (пентаглициновые мостики). Синтез пептидогликана протекает в 3 стадии:
- 1) в цитоплазме синтезируются предшественники пептидогликана (ацетилмурамилпентапептид и ацетилглюкозамин), которые переносятся через цитоплазматическую мембрану с участием липидного транспортера, ингибируемого бацитрацином;
- 2) включение этих предшественников в растущую полимерную цепь;
- 3) образование поперечных связей между двумя соседними цепями в результате реакции транспептидирования, катализируемой ферментом-транспептидазой пептидогликана.
Процесс расщепления пептидогликана катализирует фермент-муреингидролаза, активность которого в нормальных условиях сдерживается эндогенным ингибитором.
Бета-лактамные антибиотики ингибируют:
- а) транспептидазу пептидогликана, что приводит к нарушению образования пептидогликана;
- б) эндогенный ингибитор, что приводит к активации муреингидролазы, расщепляющей пептидогликан.
Бета-лактамные антибиотики малотоксичны для макроорганизма, так как мембраны клеток человека не содержат пептидогликана. Антибиотики этой группы эффективны преимущественно в отношении делящихся, а не «покоящихся» клеток, поскольку в клетках, находящихся в стадии активного роста, синтез пептидогликана происходит наиболее интенсивно.
ПЕНИЦИЛЛИНЫ
В основе строения пенициллинов лежит 6-аминопенициллановая кислота (6-АПК), которая представляет собой гетероциклическую систему, состоящую из 2 конденсированных колец: четырехчленного-(β-лактамного (А) и пятичленного-тиазолидинового (В).
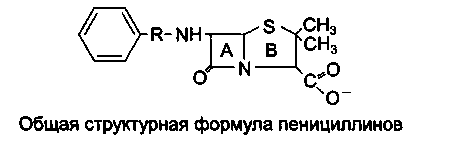
Пенициллины отличаются друг от друга строением ацильного остатка у аминогруппы 6-АПК.
Все пенициллины по способу получения можно разделить на природные (биосинтетические) и полусинтетические.
Природные пенициллины
-Природные пенициллины продуцируются различными видами плесневого гриба Penicillium.
Спектр действия природных пенициллинов включает преимущественно грам-положительные микроорганизмы: грамположительные кокки (стрептококки, пневмококки; стафилококки, не продуцирующие пенициллиназу), грамотрицательные кокки (менингококки и гонококки), грамположительные палочки (возбудители дифтерии, сибирской язвы; листерии), спирохеты (бледная трепонема, лептоспиры, боррелии), анаэробы (клостридии), актиномицеты.
Природные пенициллины применяют при тонзиллофарингите (ангине), скарлатине, роже, бактериальном эндокардите, пневмонии, дифтерии, менингите, гнойных инфекциях, газовой гангрене и актиномикозе. Препараты этой группы являются средствами выбора при лечении сифилиса и для профилактики обострений ревматических заболеваний.
Все природные пенициллины разрушаются β-лактамазами, поэтому их нельзя использовать для лечения стафилококковых инфекций, так как в большинстве случаев стафилококки вырабатывают такие ферменты.
Препараты природных пенициллинов классифицируют на:
1. Препараты для парентерального введения (кислотонеустойчивые)
- Короткого действия Бензилпенициллина натриевая и калиевая соли.
- Длительного действия
Бензилпенициллин прокаин (Бензилпенициллина новокаиновая соль), Бензатин бензилпенициллин (Бициллин-1), Бициллин-5.
2. Препараты для энтерального введения (кислотоустойчивые)
Феноксиметил пенициллин.
Бензилпенициллина натриевая и калиевая соли являются хорошо растворимыми препаратами бензилпенициллина. Быстро всасываются в системный кровоток и создают высокие концентрации в плазме крови, что позволяет их применять при острых, тяжелопротекающих инфекционных процессах. При внутримышечном введении препараты накапливаются в крови в максимальных количествах через 30—60 мин и практически полностью выводятся из организма через 3-4 ч, поэтому внутримышечные инъекции препаратов необходимо производить через каждые 3—4 ч. При тяжелых септических состояниях растворы препаратов вводят внутривенно. Бензилпенициллина натриевую соль вводят также под оболочки мозга (эндолюмбально) при менингитах и в полости тела — плевральную, брюшную, суставную (при плевритах, перитонитах и артритах). Подкожно применяют препараты для обкалывания инфильтратов. Бензилпенициллина калиевую соль нельзя вводить эндолюмбально и внутривенно, так как освобождающиеся из препарата ионы калия могут вызывать судороги и угнетение сердечной деятельности.
Необходимость частых инъекций натриевой и калиевой солей бензилпенициллина послужила поводом для создания длительно действующих препаратов бензилпенициллина (депо-пенициллинов). Вследствие плохой растворимости в воде эти препараты образуют с водой суспензии и вводятся только внутримышечно. Депо-пенициллины медленно всасываются с места введения и не создают высоких концентраций в плазме крови, поэтому они применяются при хронических инфекциях легкой и средней тяжести.
К пролонгированным пенициллинам относятся бензилпенициллин про каин , или новокаиновая соль бензилпенициллина, которая действует 12— 18 ч, бензатин бензилпенициллин (бициллин-1), действующий 7-10 дней, и бициллин-5, оказывающий противомикробное действие в течение 1 mqq.
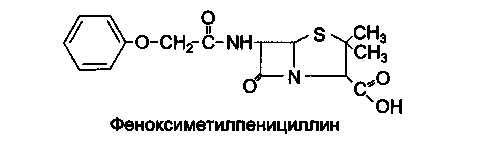
Феноксиметилпенициллин по химическому строению отличается от бензилпенициллина наличием в молекуле феноксиметильной группы вместо бензильной, что придает ему устойчивость в кислой среде желудка и делает его пригодным для применения внутрь.
Природные пенициллины имеют ряд недостатков, главными из которых являются следующие: разрушение пенициллиназой, неустойчивость в кислой среде желудка (кроме феноксиметилпенициллина) и относительно узкий спектр действия.
Полусинтетические пенициллины
В процессе поиска более совершенных антибиотиков группы пенициллина на основе 6-АПК были получены полусинтетические препараты. Химические модификации 6-АПК проводились за счет присоединения различных радикалов к аминогруппе. Основные отличия полусинтетических пенициллинов от природных касаются кислотоустойчивости, устойчивости к пенициллиназе и спектра действия.
1. Препараты узкого спектра действия, устойчивые к действию пенициллиназы
• Изоксазолиловые пенициллины
Оксациллин, Диклоксациллин.
2. Препараты широкого спектра действия, не устойчивые к действию пени
циллиназы
• Аминопенициллины
Ампициллин, Амоксициллин.
• Карбоксипенициллины
Карбенициллин, Карфециллин, Тикарциллин.
• Уреидопенициллины
Азлоциллин, Пиперациллин, Мезлоциллин. Полусинтетические пенициллины, устойчивые к действию пенициллиназы, отличаются от препаратов бензилпенициллина тем, что они эффективны при инфекциях, вызываемых пенициллиназообразующими стафилококками, поэтому препараты этой группы получили название «антистафилококковые» пенициллины. В остальном спектр действия соответствует спектру природных пенициллинов, но активность значительно ниже.

Оксациллин устойчив в кислой среде желудка, но всасывается из желудочно-кишечного тракта всего на 20—30%. Значительная часть связывается с белками крови. Через ГЭБ не проникает.
Препарат применяется внутрь, внутримышечно и внутривенно.
Диклоксациллин отличается от оксациллина высокой степенью абсорбции из желудочно-кишечного тракта (40—45%).
Аминопенициллины отличаются от препаратов бензилпенициллина более широким спектром действия, а также кислотоустойчивостью.
Спектр действия аминопенициллинов включает как грамположительные микроорганизмы, так и грамотрицательные (сальмонеллы, шигеллы, кишечную палочку, некоторые штаммы протея, гемофильную палочку). Препараты этой группы не действуют на синегнойную палочку и пенициллиназообразующие стафилококки.
Аминопенициллины применяют при острых бактериальных инфекциях верхних дыхательных путей, бактериальном менингите, кишечных инфекциях, инфекциях желче- и мочевыводящих путей, а также для эрадикации Helicobacter pylori при язвенной болезни желудка.

Ампициллин из желудочно-кишечного тракта всасывается неполно (30-40%). В плазме крови незначительно (до 15—20%) связывается с белками. Плохо проникает через ГЭБ. Из организма выводится с мочой и желчью, где создаются высокие концентрации препарата. Препарат вводят внутрь и внутривенно.
Амоксициллин является производным ампициллина со значительно улучшенной фармакокинетикой при приеме внутрь. Хорошо всасывается из желудочно-кишечного тракта (биодоступность 90-95%) и создает более высокие концентрации в плазме крови. Применяется только внутрь.
В медицинской практике используют комбинированные препараты, содержащие разные соли ампициллина и оксациллина. К числу таких препаратов относятся ампиокс (смесь ампициллина тригидрата и натриевой соли оксациллина в соотношении 1:1) и ампиокс-натрий (смесь натриевых солей ампициллина и оксациллина в соотношении 2:1). Эти препараты сочетают широкий спектр действия и устойчивость к пенициллиназе. В связи с этим ампиокс и ампиокс-натрий применяют при тяжело протекающих инфекционных процессах (сепсис, эндокардит, послеродовая инфекция и др.); при неустановленной антибиотикограмме и невыделенном возбудителе; при смешанной инфекции, вызванной грамположительными и грамотрицательными микроорганизмами. Ампиокс применяется внутрь, а ампиокс-натрий вводится внутримышечно и внутривенно.
Главным достоинством карбокси- и уреидопенициллинов является активность в отношении синегнойной палочки (Pseudomonas aeruginosa), в связи с чем эти пенициллины называются «антисинегнойными». Основным показанием для препаратов этой группы являются инфекции, вызванные синегнойной палочкой, протеем, кишечной палочкой (сепсис, раневые инфекции, пневмонии и др.).
Карбенициллин разрушается в желудочно-кишечном тракте, поэтому вводится внутримышечно и внутривенно. Через ГЭБ не проникает. Около 50% препарата связываются с белками плазмы крови. Выводится преимущественно почками.
Карфециллин, в отличие от карбенициллина, кислотоустойчив и применяется внутрь. Тикарциллин активнее карбенициллина, особенно по влиянию на синегнойную палочку.
Уреидопенициллины в 4—8 раз превосходят карбоксипенициллины по активности в отношении синегнойной палочки. Вводятся парентерально.
Все полусинтетические пенициллины широкого спектра действия разрушаются бактериальными б-лактамазами (пенициллиназами), что значительно снижает их клиническую эффективность. Исходя из этого, были получены соединения, инактивирующие б-лактамазы бактерий. К ним относятся клавулановая кислота, сульбактам и тазобактам. Они входят в состав комбинированных препаратов, содержащих полусинтетический пенициллин и один из ингибиторов б-лактамаз. Такие препараты получили название «ингибиторзащищенных пенициллинов». В отличие от монопрепаратов, ингибиторзащищенные пенициллины действуют на пенициллиназообразующие штаммы стафилококков, обладают высокой активностью в отношении грамотрицательных бактерий, продуцирующих б-лактамазы, а также эффективны в отношении бактероидов.
Фармацевтической промышленностью выпускаются следующие комбинированные препараты: амоксициллин/клавулановая кислота (Амоксиклав, Аугментин), ампициллин/сульбактам (Уназин), пиперациллин/тазобактам (Тазоцин).
Препараты группы пенициллина малотоксичны и обладают большой широтой терапевтического действия. Однако они относительно часто вызывают аллергические реакции, которые могут проявляться в виде крапивницы, кожной сыпи, отека Квинке, бронхоспазма и анафилактического шока. Аллергические реакции могут возникать при любом пути введения препарата, но наиболее часто наблюдаются при парентеральном введении. Лечение аллергических реакций заключается в отмене препаратов пенициллина, а также во введении антигистаминных средств и глюкокортикостероидов. При анафилактическом шоке внутривенно вводят адреналин и глкжокортикостероиды.
Кроме того, пенициллины вызывают некоторые побочные эффекты неаллергической природы. К ним относится раздражающее действие. При приеме внутрь они могут вызывать тошноту, воспаление слизистой оболочки языка и ротовой полости. При внутримышечном введении могут быть болезненность и развитие инфильтратов, а при внутривенном — флебиты и тромбофлебиты.
ЦЕФАЛОСПОРИНЫ
К цефалоспоринам относится группа природных и полусинтетических антибиотиков, имеющих в своей основе 7-аминоцефалоспорановую кислоту (7-АЦК).
По химическому строению основа этих антибиотиков (7-АЦК) имеет сходство с 6-АПК. Однако имеются и существенные различия: структура пенициллинов включает тиазолидиновое кольцо, а цефалоспоринов — дигидротиазиновое.
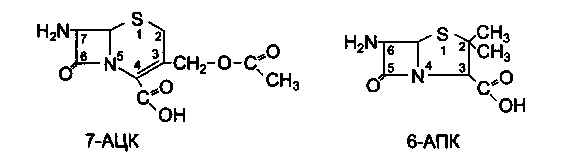
Имеющиеся черты структурного сходства цефалоспоринов с пенициллинами предопределяют одинаковый механизм и тип антибактериального действия, высокую активность и эффективность, низкую токсичность для макроорганизма, а также перекрестные аллергические реакции с пенициллинами. Важными отличительными особенностями цефалоспоринов являются их устойчивость к пенициллиназе и широкий спектр антимикробного действия.
Цефалоспорины принято классифицировать по поколениям, внутри которых выделяют препараты для парентерального и энтерального введения (табл. 37.2).
Таблица 37.2. Классификация цефалоспоринов
| Путь введения | Поколения цефалоспоринов | |||
| I | II | III | IV | |
| Парентеральный
(внутривенно, внутримышечно) |
Цефазолин | Цефуроксим | Цефотаксим
Цефтриаксон Цефтазидим Цефоперазон |
Цефепим Цефпиром |
| Пероральный | Цефалексин Цефадроксил | Цефуроксим аксетил Цефаклор | Цефиксим | |
Цефалоспорины I поколения
Цефалоспорины I поколения обладают широким спектром действия с преимущественным влиянием на грамположительную флору и сопоставимы по спектру и силе действия с аминопенициллинами. Основной особенностью препаратов этого поколения является их высокая антистафилококковая активность, в том числе против б-лактамазообразующих штаммов. Цефалоспорины I поколения действуют на некоторые грамотрицательные бактерии (кишечную палочку и клебсиелл), но разрушаются б-лактамазами грамотрицательных микроорганизмов. К препаратам I поколения первично резистентны синегнойная палочка, протей, энтерококки и бактероиды.
Цефалоспорины I поколения применяются при тонзиллофарингите, инфекциях кожи и мягких тканей, а также для профилактики послеоперационных осложнений.
Цефазолин (Кефзол) при парентеральном введении хорошо проникает в различные органы и ткани, но плохо — через ГЭБ. Создает высокие концентрации в плазме крови. Выделяется почками в неизмененном виде.
Цефалексин (Кефлекс) по спектру активности близок к цефазолину, но хуже действует на грамотрицательные бактерии. Хорошо всасывается из желудочно-кишечного тракта, но высоких концентраций в крови и большинстве органов и тканей не создает. Терапевтическая концентрация в крови после однократного введения сохраняется в течение 4—6 ч.
Цефалоспорины II поколения
Цефалоспорины II поколения отличаются от препаратов I поколения более высокой активностью в отношении грамотрицательных микроорганизмов (кишечной палочки, протея, сальмонелл, шигелл). Препараты этого поколения более устойчивы к действию б-лактамаз грамотрицательных бактерий. Как и цефалоспорины I поколения, не действуют на синегнойную палочку.
Цефалоспорины II поколения применяются при бактериальных инфекциях верхних и нижних дыхательных путей, инфекциях мочевыводящих путей, инфекциях кожи, мягких тканей, костей и суставов, а также для периоперационной антибиотикопрофилактики в хирургии.
Цефуроксим (Кетоцеф) при парентеральном введении хорошо проникает во многие органы и ткани, в том числе через ГЭБ (при воспалении). Выводится преимущественно почками.
Цефуроксим-аксетил (Зиннат) — производное цефуроксима для приема внутрь, представляет собой пролекарство.
Цефаклор — хорошо всасывается из желудочно-кишечного тракта, проникает во многие органы и ткани, через ГЭБ не проходит. Выводится с мочой. с
Цефалоспорины III поколения
Цефалоспорины III поколения отличаются высокой активностью в отношении большинства грамотрицательных бактерий, в том числе резистентных к другим антибиотикам. Некоторые из цефалоспоринов III поколения (цефтазиди^м, цефоперазон) действуют на синегнойную палочку. Вместе с тем по действию на стафилококки, стрептококки и другие грамположительные бактерии цефалоспорины III поколения уступают препаратам I—II поколений. Все цефалоспорины этого поколения устойчивы к действию б-лактамаз грамотрицательных микроорганизмов.
Показания к назначению цефалоспоринов III поколения включают инфекции разной локализации: верхних и нижних дыхательных путей, мочевыводящих путей, кожи, мягких тканей, кишечные инфекции, сепсис, гонорея, менингит.
Цефотаксим (Клафоран) — основной представитель цефалоспоринов III поколения для парентерального введения. Препарат хорошо проникает в различные ткани и проходит через ГЭБ. Метаболизируется в печени. Выделяется через почки. Т около 1 ч.
Цефтриаксон (Лонгацеф) по спектру активности сходен с цефотаксимом, но имеет более длительный t (5—7 ч). Является средством выбора при гонорее.
Цефтазидим (Фортум) ицефоперазон (Цефобид) отличается высокой активностью в отношении синегнойной палочки, поэтому применяются преимущественно при инфекциях, вызванных этим возбудителем.
Цефалоспорины IV поколения
У цефалоспоринов IV поколения еще более широкий спектр антимикробного действия, чем у препаратов III поколения. Они более эффективны в отношении грамположительных кокков. Для них характерна более высокая устойчивость к действию б-лактамаз.
Применяются цефалоспорины IV поколения при тяжелых инфекциях, вызванных полирезистентной микрофлорой, а также для лечения инфекций у пациентов с иммунодефицитом.
Цефепим (Максипим) и цефпером (Кейтен) при парентеральном введении хорошо проникают во многие органы и ткани, проникают через ГЭБ. Выводятся преимущественно в неизмененном виде через почки.
При применении цефалоспоринов возможно развитие аллергических реакций (крапивница, лихорадка, сывороточная болезнь, анафилактический шок). Больным, имеющим в анамнезе аллергические реакции на пенициллины, не должны назначаться цефалоспорины. Из неаллергических осложнений возможно нарушение функции почек, что наиболее характерно для цефалоспоринов I поколения. В редких случаях цефалоспорины вызывают лейкопению. Для ряда цефалоспоринов, имеющих в структуре 4-метилтиотетразольное кольцо (цефоперазон и др.), характерно тетурамоподобное действие. При приеме пероральных цефалоспоринов могут возникать диспептические явления. При внутримышечном введении цефалоспоринов могут возникать инфильтраты, а при внутривенном — флебиты. При приеме цефалоспоринов следует учитывать возможность развития суперинфекции.
КАРБАПЕНЕМЫ
Имипенем, Тиенам, Меропенем
Карбапенемы относятся к группе β-лактамных антибиотиков. Они характеризуются более высокой устойчивостью к действию β-лактамаз и обладают широким спектром антибактериального действия, включая штаммы, устойчивые к цефалоспоринам III и IV поколений.
Карбапенемы являются резервными антибиотиками и применяются при тяжелых инфекциях, вызванных полирезистентными штаммами микроорганизмов.
К группе карбапенемов относятся имипенем и меропенем.
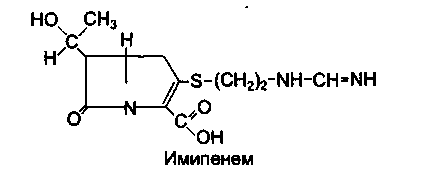
Ймипенем является производным тиенамицина, продуцируемого Streptomyces cattleya. Для медицинского применения выпускается комбинированный препарат, содержащий ймипенем в сочетании со специфическим ингибитором дегидропептидазы-I почечных канальцев — циластатином. Такое сочетание тормозит метаболизм имипенема в почках и значительно повышает концентрацию неизмененного антибиотика в почках и мочевыводящих путях. Этот комбинированный препарат носит название «Тиенам».
Тиенам вводится внутривенно. Хорошо проникает во многие органы и ткани, проходит через ГЭБ при воспалении оболочек мозга. t(/i составляет 1 ч. При применении препарата возможны аллергические реакции, тошнота, рвота, судороги.
Меропенем (Меронем) в отличие от имипенема не разрушается дегидропептидазой почечных канальцев, поэтому применяется без ее ингибиторов. По остяттъным хяпятгтепистикям близок к имипенему.
МОНОБАКТАМЫ
Азтреонам
Антибиотики этой группы имеют в своей структуре моноциклическое β-лактамное кольцо. Из монобактамов в медицинской практике применяется один антибиотик — азтреонам. Препарат проявляет высокую активность в отношении грамотрицательных бактерий (кишечной и синегнойной палочек, протея, клебсиелл и др.) и не действует на грамположительные бактерии, бактероиды и другие анаэробы.
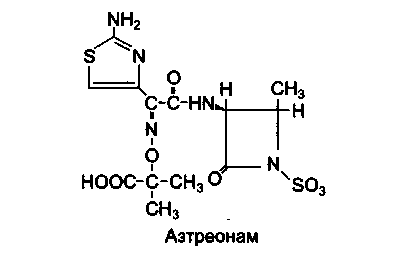
Своеобразие антимикробного спектра действия азтреонама обусловлено тем, что он устойчив ко многим б-лактамазам, продуцируемым грамотрицательной флорой, и в то же время разрушается β-лактамазами грамположительных микроорганизмов и бактероидов.
Азтреонам является препаратом резерва и применяется при тяжелых инфекциях мочевыводящих путей, брюшной полости и малого таза, менингите, сепсисе, при неэффективности других антибактериальных средств. Вводят препарат внутримышечно или внутривенно. Из побочных эффектов отмечаются диспептические нарушения, кожные аллергические реакции, головная боль.
МАКРОЛИДЫ И БЛИЗКИЕ К НИМ АНТИБИОТИКИ
Макролиды представляют собой класс антибиотиков, основу химической структуры которых составляет макроциклическое лактонное кольцо, связанное с различными сахарами.
Макролиды классифицируют в зависимости от способов получения и количества атомов углерода в макроциклическом лактонном кольце (табл. 37.3).
Таблица 37.3. Классификация макролидов
| Макролиды | 14-членные | 15-членные (азалиды) | 16-членные |
| Природные | Эритромицин Олеандомицин | Спирамицин Джозамицин Мидекамицин | |
| Полусинтетические | Рокситромицин Кларитромицин | Азитромицин | Мидекамицина ацетат |
Для антибиотиков-макролидов характерны следующие общие свойства: 1. Способность нарушать синтез микробных белков на уровне рибосом. Они связываются с 508-субъединицей бактериальных рибосом и нарушают процесс образования пептидных связей (ингибируют процесс транслокации). Резистентность микроорганизмов к макролидам связана с изменениями структуры рецепторов на 50S-субъединицах бактериальных рибосом, что нарушает связывание антибиотика с рибосомами.
- Преимущественно бактериостатический тип действия. В высоких концентрациях оказывают бактерицидное действие на пневмококков, возбудителей коклюша и дифтерии.
- Высокая активность в отношении грамположительных кокков (стрептококков, стафилококков) и внутриклеточных возбудителей (хламидий и микоплазм).
- Способность проникать внутрь клеток и создавать высокие внутриклеточные концентрации.
- Низкая токсичность для макроорганизма.
- Отсутствие перекрестных аллергических реакций с бета-лактамными антибиотиками.
Спектр действия макролидов включает: грамположительные кокки (стрептококки, стафилококки), грамположительные палочки (возбудители дифтерии, листерии), грамотрицательные кокки (гонококки, менингококки), грамотрицательные палочки (легионеллы, хеликобактерии), хламидий, микоплазмы, спирохеты.
Таким образом, по спектру антимикробного действия макролиды напоминают препараты бензилпенициллина.
Макролиды применяются для лечения стрептококкового тонзиллофарингита, пневмонии (в том числе — «атипичной», вызванной микоплазмами, хламидиями и легионеллами), коклюша, дифтерии, скарлатины, инфекций кожи и мягких тканей, хламидиоза, микоплазменной инфекции, инфекций полости рта, а также с целью круглогодичной профилактики ревматизма (при аллергии на пенициллины).
Эритромицин — природный макролид, продуцируемый Streptomyces erythreus. Препарат при назначении внутрь медленно всасывается из желудочно-кишечного тракта, частично разрушается в кислой среде желудка.
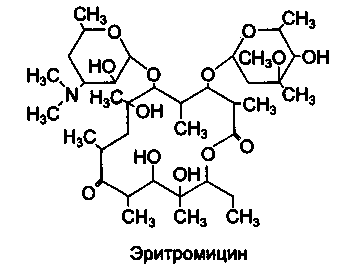
В присутствии пищи биодоступность резко снижается. Хорошо проникает в бронхиальный секрет, желчь. Плохо проходит через ГЭБ. Выводится преимущественно через желудочно-кишечный тракт. Длительность действия 4-6 ч.
Олеандомицин продуцируется Streptomyces antibioticus. По спектру активности близок к эритромицину, но менее активен.
Рокситромицин (Рулид) и кларитромицин (Клацид) — полусинтетические 14-членные макролиды. Эффективны при применении внутрь. В отличие от эритромицина хорошо всасываются из желудочно-кишечного тракта, при этом пища не влияет на абсорбцию препаратов. Создают высокие концентрации в тканях. Действуют более продолжительно. X рокситромицина составляет 13 ч, кларитромицина — 3—4 ч.
Кроме вышеперечисленных показаний, кларитромицин применяется для эрадикации Helicobacter pylory при язвенной болезни желудка и двенадцатиперстной кишки, а также для профилактики и лечения атипичных микобактериозов при СПИДе.
Азитромицин (Сумамед) — полусинтетический 15-членный макролид, относится к подклассу азалидов, так как в макроциклическом кольце содержит атом азота. В отличие от эритромицина более активен в отношении грамотрицательных микроорганизмов. Создает самые высокие среди макролидов концентрации в тканях. Препарат имеет длительный t (35—55 ч), что дает возможность назначать препарат один раз в сутки.
Спирамицин, джозамицин и мидекамицин -природные 16-членные макролиды. Препараты эффективны в отношении некоторых штаммов стрептококков и стафилококков, резистентных к эритромицину. Хорошо всасываются из желудочно-кишечного тракта, при этом пища практически не влияет на биодоступность. Мидекамицина ацетат — полусинтетический антибиотик с улучшенной фармакокинетикой.
Побочное действие препаратов данной группы проявляется, в основном, аллергическими реакциями и диспептическими расстройствами.
ЛИНКОСАМИДЫ
Линкомицин, Клиндамицин
В группу линкосамидов входят природный антибиотик линкомицин и его полусинтетический аналог — клиндамицин.
Для антибиотиков-линкосамидов характерны следующие общие свойства:
- способность ингибировать синтез белка в микробной клетке (действуют подобно макролидам);
- преимущественно бактериостатический тип действия. В высоких концентрациях могут действовать бактерицидно на грамположительные кокки;
- узкий спектр действия (преимущественно грамположительные кокки, включая пенициллиназообразующие штаммы стафилококков). Высокоактивны в отношении бактероидов — облигатных неспорообразующих анаэробов;
- способность накапливаться в костной ткани и суставах;
- быстрое развитие устойчивости микрофлоры;
- отсутствие перекрестных аллергических реакций с бета-лактамными антибиотиками.
Линкосамиды применяются как резервные антистафилококковые препараты при тонзиллофарингите, пневмонии, инфекциях кожи, мягких тканей, костей и суставов, а также при инфекциях, вызванных бактероидами.
Линкомицин всасывается из желудочно-кишечного тракта, при этом пища нарушает абсорбцию препарата. Метаболизируется в печени, выводится преимущественно с желчью.
К л индамицин (Далацин С) — более активен, чем линкомицин. В высоких дозах действует на токсоплазмы и плазмодии, поэтому дополнительными показаниями к применению являются тропическая малярия (в сочетании с хинином) и токсоплазмоз (в сочетании с пириметамином). У клиндамицина более высокая биодоступность, не зависящая от приема пищи.
При применении линкосамидов могут возникать диспептические расстройства, аллергические реакции.
Наиболее тяжелым побочным эффектом является псевдомембранозный колит, который развивается в результате подавления неспорообразующей анаэробной флоры кишечника и размножения Clostridium difficile, продуцирующего энтеротоксины, вызывающие деструктивные изменения в стенке кишечника. Колит имеет тяжелое течение, развиваются язвы, вплоть до прободения кишечника и развития перитонита. Для лечения колита назначают внутрь ванкомицин или метронидазол, а также проводят дезинтоксикационную терапию.
АМИНОГЛИКОЗИДЫ
В основе молекулы аминогликозидов лежит циклический спирт-аминоциклитол, к которому присоединены аминосахара. Группа аминогликозидов представлена природными и полусинтетическими препаратами, которые принято классифицировать по поколениям:
- Аминогликозиды I поколения: стрептомицин, неомицин, канамицин.
- Аминогликозиды II поколения: гентамицин, тобрамицин, сизомицин.
- Аминогликозиды III поколения: амикацин.
Все аминогликозиды близки по своим свойствам и различаются, главным образом, по активности, спектру действия, выраженности побочных эффектов и устойчивости микроорганизмов.
К общим свойствам аминогликозидов относятся следующие:
- способность нарушать синтез белка в микробной клетке. Аминогликозиды связываются с 30S-субъединицей рибосом бактериальной клетки, что нарушает движение рибосомы по нити матричной РНК. Аминогликозиды также нарушают процессы считывания кода мРНК, что приводит к синтезу функционально неактивных белков;
- способность нарушать проницаемость цитоплазматической мембраны микроорганизмов;
- бактерицидный тип действия;
- потенцирование антибактериального действия пенициллинов и цефалоспоринов;
- широкий спектр антибактериального действия с преимущественным влиянием на грамотрицательную флору;
- высокая токсичность для человека, которая выражается в специфическом повреждении почек (нефротоксический эффект), слухового и вестибулярного аппарата (ототоксический эффект), угнетении нервно-мышечной передачи, проявляющимся ослаблением дыхания, снижением мышечного тонуса и двигательной функции;
- сходные фармакокинетические свойства — аминогликозиды практически не всасываются из желудочно-кишечного тракта (высокогидрофильны), плохо проходят через гистагематические барьеры, практически не метаболизируются и выводятся почками в неизмененном виде, создавая в моче высокие концентрации.
Спектр действия аминогликозидов включает многие грамположительные и грамотрицательные микроорганизмы: стафилококки, стрептококки, пневмококки, кишечную палочку, сальмонеллы, шигеллы, клебсиеллы, протей, энтеробактерии, синегнойную палочку. Аминогликозиды I поколения оказывают угнетающее влияние на микобактерии туберкулеза, возбудителей туляремии и чумы. К аминогликозидам не чувствительны анаэробы, спирохеты и простейшие.
Применяют аминогликозиды при инфекциях различной локализации, вызванных грамотрицательными микроорганизмами, при синегнойной инфекции, а также при туберкулезе, чуме, туляремии, бруцеллезе.
Аминогликозиды I поколения в настоящее время применяются ограниченно в связи с быстрым развитием устойчивости микрофлоры и высокой токсичностью.
Стрептомицин применяется для лечения туберкулеза и терапии ряда особо опасных инфекций (чума, туляремия) в комбинации с тетрациклином. Вводят препарат чаще всего внутримышечно. Оказывает выраженное ототоксическое действие.
Неомицин является самым ототоксичным аминогликозидом. Применяется внутрь для санации кишечника при подготовке к операциям на желудочно-кишечном тракте (неомицин не всасывается в кишечнике) и местно для лечения гнойных поражений кожи (пиодермии, инфицированные экземы и др.). Наружно неомицин иногда используют с глюкокортикостероидами (входит в состав комбинированных мазей Локакартен-Н, Синалар-Н и др.). Для парентерального введения препарат не используют в связи с высокой токсичностью.
Канамицин применяется внутрь по тем же показаниям, что и неомицин, и парентерально для лечения туберкулеза.
Аминогликозиды II поколения высокоактивны в отношении синегнойной палочки и ряда других микроорганизмов, устойчивых к препаратам I поколения и антибиотикам других групп. К препаратам этого поколения медленнее развивается устойчивость.
Основным представителем аминогликозидов II поколения является гентамицин. Препарат применяется, главным образом, при тяжелых инфекциях (сепсисе, пневмонии, эндокардите, инфекциях мочевыводящих путей и др.), вызванных грамотрицательными бактериями, устойчивыми к другим антибиотикам. Вводят препарат внутримышечно и внутривенно. Гентамицин используют также местно при лечении инфицированных ран и ожогов. При применении гентамицина возникают побочные эффекты, типичные для аминогликозидов.
Тобрамицин и сизомицин аналогичны по своим свойствам гентамицину.
К аминогликозидам III поколения относится амикацин. В отличие от гентамицина амикацин действует на многие штаммы грамотрицательных бактерий, резистентных к аминогликозидам II поколения, поскольку он не инактивируется бактериальными ферментами. Применяется препарат для лечения наиболее тяжелых инфекций, вызванных множественно устойчивой микрофлорой. Вводится внутримышечно и внутривенно.
При парентеральном применении аминогликозидов необходим систематический контроль за функцией почек, состоянием слуха и вестибулярной системы. Аминогликозиды противопоказаны при заболеваниях почек и слухового нерва, беременности, миастении.
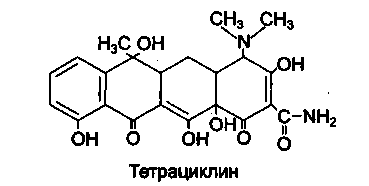
ТЕТРАЦИКЛИНЫ
К группе тетрациклинов относятся природные и полусинтетические антибиотики, структурную основу которых составляют 4 конденсированных шести-членных кольца.
Классифицируют тетрациклины в зависимости от способа получения: А. Природные (биосинтетические) антибиотики
Тетрациклин, окситетрациклин. Б. Полусинтетические антибиотики
Метациклин (Рондамицин), доксициклин (Вибрамицин). Общие свойства тетрациклинов следующие:
- способность ингибировать синтез микробных белков на уровне рибосом. Тетрациклины связываются с 308-субъединицей бактериальных рибосом, в результате чего приостанавливается процесс удлинения полипептидной цепи;
- бактериостатический тип действия. Тетрациклины наиболее активны в отношении размножающихся микроорганизмов;
- широкий спектр противомикробного действия;
- высокая активность в отношении внутриклеточных микроорганизмов;
- большая липофильность, обеспечивающая препаратам высокую степень всасывания из желудочно-кишечного тракта, способность преодолевать биологические барьеры и накапливаться в тканях;
- способность связывать, в хелатные комплексы двухвалентные ионы — железа, кальция, магния, цинка.
Как антибиотики широкого спектра действия тетрациклины применяются при многих инфекционных заболеваниях. В первую очередь тетрациклины показаны при бруцеллезе, риккетсиозах (сыпной тиф, лихорадка Ку и др.), чуме, холере, туляремии. Тетрациклины назначают при заболеваниях, вызываемых кишечной палочкой (перитониты, холециститы и др.), дизентерийной палочкой (бациллярная дизентерия), спирохетами (сифилис), хламидиями (трахома, орнитоз, мочеполовой хламидиоз и др.), микоплазмами (возбудителями атипичной пневмонии). Тетрациклины также используют для эрадикации Helicobacter pylori при язвенной болезни желудка и двенадцатиперстной кишки.
Широкое применение тетрациклинов в медицинской практике привело к появлению большого количества резистентных к этим антибиотикам штаммов стафилококков, энтерококков и пневмококков. При этом вырабатывается перекрестная устойчивость по отношению ко всем препаратам тетрациклинового ряда.
Длительность антибактериального действия препаратов данной группы неодинакова. По этому признаку среди них следует различать:
а) тетрациклины короткого действия (6-8 ч) — тетрациклин и окситетрациклин;
б) тетрациклины длительного действия (12-24 ч) — метациклин и докси
циклин.
Тетрациклины обычно назначают внутрь (в капсулах или таблетках, покрытых оболочкой). Препараты короткого действия назначают 4 раза в сутки, длительного — 1-2 раза в сутки. Кроме того, при тяжелых формах гнойно-септических заболеваний растворимые соли тетрациклинов вводят парентерально (внутримышечно, внутривенно, в полости тела).
При применении тетрациклинов нередко возникают побочные эффекты аллергической и неаллергической природы. Наиболее частым проявлением аллергических реакций является кожная сыпь и крапивница, в редких случаях могут возникнуть отек Квинке и анафилактический шок.
Из побочных эффектов неаллергической природы следует отметить раздражающее действие на слизистые пищеварительного тракта (тошнота, рвота, боли в животе, метеоризм, поносы) при пероральном применении, а при внутривенном введении в случае попадания на стенку вены — образование тромбофлебитов.
Тетрациклины оказывают гепатотоксическое действие, особенно выраженное при нарушении функций печени.
Антибиотики данной группы оказывают общее катаболическое действие: угнетают синтез белка, способствуют выведению из организма аминокислот, витаминов и других соединений.
Тетрациклины депонируются в костной ткани, в том числе в тканях зубов, и образуют труднорастворимые комплексы с кальцием, в связи с чем нарушается образование скелета, происходит окрашивание и повреждение зубов. По этой причине тетрациклины не следует назначать детям до 12 лет и беременным.
Характерным побочным эффектом тетрациклинов является дисбактериоз и суперинфекция с возникновением орального и других видов кандидоза. В редких случаях может возникнуть псевдомембранозный энтероколит.
Противопоказаны тетрациклины при беременности, кормлении грудью, тяжелой патологии печени и почек.
