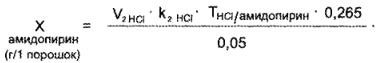Анализ смесей, содержащих вещества с различными кислотно-основными и окислительно-восстановительными свойствами
Глава 18. Анализ лекарственных смесей в условиях аптек
- Определение ингредиентов смесей с различными кислотно-основными свойствами.
- Определение смесей кислот и смесей оснований
Если 2 ингредиента смеси обладают кислотными свойствами, а один из них является восстановителем, возможно их количественное определение в одной навеске. Примером такой лекарственной смеси является пропись 22.
Пропись 22.
Кислоты глутаминовой 0,3
Кислоты аскорбиновой 0.1
Для количественного определения ингредиентов проводят последовательное титрование вначале суммы кислот стандартным раствором натрия гидроксида, а затем йодометрическим методом в той же аликвотной доле определяют кислоту аскорбиновую.
Расчет содержания кислоты глутаминовой проводят по разности титрований с учетом эквивалентных объемов титрантов, когда количество 0,1 н. раствора йода, пошедшего на титрование кислоты аскорбиновой, в 2 раза больше, чем количество 0,1 н. раствора натрия гидроксида, израсходованного на такую же массу кислоты аскорбиновой

Реакции кислоты аскорбиновой с натрия гидроксидом и йодом — см. пропись 15.
Методика.
Кислота глутаминовая и кислота аскорбиновая. 0,1 г порошка растворяют в 5 мл воды, добавляют 2 капли раствора нейтрального красного и титруют 0,1 н, pacтвором натрия гидроксида до желтого окрашивания.
Кислота аскорбиновая. К оттитрованной жидкости прибавляют крахмал и титруют 0,1 н. раствором йода до синего окрашивания.
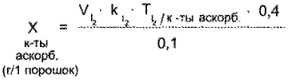
1 мл 0,1 н. корбиновой раствора йода соответствует 0,008806 г кислоты аскорбиновой
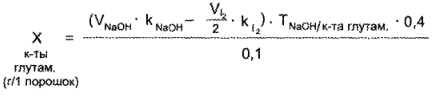
1 мл 0,1 и. раствора натрия гидроксида соответствует 0,01471 г С5Н9NО4 (кислоты глутаминовой).
Определение натрия гидрокарбоната и натрия тетрабората также можно провести в одной навеске на основании того, что при ацидиметрическом титровании смеси образуется эквивалентное натрия тетраборату количество кислоты борной, которое определяется методом алкалиметрии.
Примером является пропись 23.
Пропись 23.
Натрия хлорида 0,2
Натрия гидрокарбоната
Натрия тетрабората по 0,4
Воды очищенной до 40,0 мл.
Смесь титруют стандартным раствором кислоты хлороводородной, объем которой соответствует сумме натрия гидрокарбоната и натрия тетрабората:
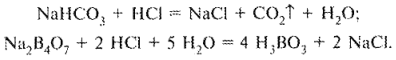
Выделившуюся борную кислоту в присутствии глицерина титруют стандартным раствором натрия гидроксида:

Количество 0.1 н. раствора натрия гидроксида используют .для расчета натрия тетрабората. А натрия гидрокарбонат определяют по разности между объемами стандартных растворов кислоты хлороводородной и натрия гидроксида.
Методика.
Натрия хлорид. К 1 мл раствора прибавляют 3—4 капли раствора бромфенолового синего и по каплям кислоту уксусную разведенную — до прекращения выделения пузырьков углерода (IV) оксида и появления зеленовато-желтого окрашивания и титруют 0,1 н. раствором серебра нитрата до окрашивания осадка в фиолетовый цвет.
1 мл 0,1 и. раствора серебра нитрата соответствует 0,005844 г NaCl
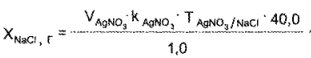
Натрия тетраборат и натрия гидрокарбонат. К 1 мл раствора прибавляют 3 мл свежепрокиняченной охлажденной воды, 2-3 капли метилового оранжевого и титруют 0,1 и. раствором кислоты хлороводородной до появления розового окрашивания.
Оттитрованный раствор нагревают до кипения (для удаления углекислоты), охлаждают, прибавляют 2 мл нейтрализованного по фенолфталеину глицерина и титруют 0,1 н. раствором натрия гидроксида.
1 мл 0.1 н. раствора натрия гидроксида соответствует 0,009534 г Na2B4O7*10H2O
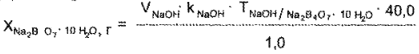
Содержание натрия гидрокарбоната определяют по формуле:
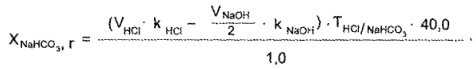
1 мл 0,1 н. раствора кислоты хлороводородной соответствует 0,008400 г NaНСО3 (натрия гидрокарбоната).
Расчет содержания ингредиентов смеси по разности возможен с использованием 2 и более титрованных растворов (как в прописи 24).
Пропись 24.
Кислоты аскорбиновой 0,2
Пиридоксина гидрохлорида 0,05
Кислоты никотиновой 0,02,
Сумму 3 кислот — аскорбиновой, никотиновой и хлороводородной (пиридоксина гидрохлорид является солью слабого основания и сильной кислоты) — определяют алкалиметрически с применением 0,1 н. раствора натрия гидроксида.
Кислоту аскорбиновую (как восстановитель) определяют методом йодометрии в отдельной навеске 0,1 н. раствором йода.
Пиридоксина гидрохлорид определяют аргентометрически.
Расчет содержания кислоты никотиновой проводят по разности титрований с учетом эквивалентных объемов титрантов.
Методика.
Кислота аскорбиновая, кислота никотиновая, пиридоксина гидрохлорид. Точную навеску, соответствующую массе I порошка, помещают в мерную колбу емкостью 50 мл, растворяют в 10 мл воды, добавляют 1—2 капли нейтрального красного и титруют 0,1 н. раствором натрия гидроксида до желтого окрашивания. Объем оттитрованного раствора доводят водой до метки (раствор А).
Кислота аскорбиновая, К 10 мл раствора А прибавляют 1 мл раствора крахмала и титруют 0,1 н. раствором йода до синего окрашивания.
1 мл 0,1 н. раствора йода соответствует 0,008806 г кислоты аскорбиновой.
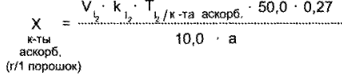
где а — масса навески, г;
10,0 — объем аликвотной части, мл;
50,0 — объем разведения, мл;
0,27 — масса порошка по прописи.
Пиридоксина гидрохлорид. К 10 мл раствора А прибавляют 2—3 капли бромфенолового синего, по каплям кислоту уксусную, разведенную до получения зеленовато-желтого окрашивания, и титруют 0,1 н. раствором серебра нитрата до сине-фиолетового окрашивания.
1 мл 0,1 н. раствора серебра нитрата соответствует 0,02056 г C8H11NO3 • HCl (пиридоксина гидрохлорида).
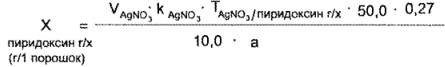
Содержание кислоты никотиновой в граммах на один порошок рассчитывают по формуле:
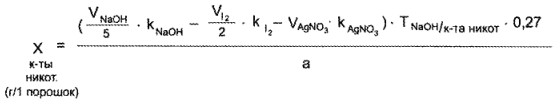
где VNaОН/5 — объем 0,1 н. раствора натрия гидроксида, пошедший на титрование суммы ингредиентов с учетом последовательного титрования лекарственных веществ, в мл.
1 мл 0,1 н. раствора натрия гидроксида соответствует 0,01231 г С6Н5О2N (кислоты никотиновой).
Определение ингредиентов смесей с различными кислотноосновными свойствами
Если в состав смеси входят вещества, различающиеся по кислотным или основным свойствам, их определение возможно в одной пробе методом нейтрализации путем последовательного титрования с различными индикаторами. Таким образом могут быть определены смеси, содержащие кислоты, основания, а также соли, образованные сильными основаниями и слабыми кислотами или сильными кислотами и слабыми основаниями.
Известно, что при титровании сильных кислот и сильных оснований можно применять любые индикаторы, предназначенные для метода нейтрализации и имеющие интервал перехода окраски от pH 4 до pH 10, так как в результате реакции образуются вода и негидролизующаяся соль и реакция среды раствора становится нейтральной.
При добавлении избытка титрованного раствора концентрация ионов Н3О+ или ОН— в растворе быстро возрастает, что приводит к резкому изменению цвета индикатора.
При титровании слабых кислот, слабых оснований или солен, подвергающихся гидролизу, следует подбирать индикатор таким образом, чтобы среднее значение pH интервала перехода окраски индикатора совпало с pH среды в конечной точке титрования или было близким к нему.
При титровании сильных кислот сильными основаниями (и наоборот) к концу титрования происходил резкий скачок pH. При титровании слабых кислот, слабых оснований или их солей скачок pH значительно меньше. В этих случаях для выбора индикатора рассчитывают значение pH в точке эквивалентности с использованием констант ионизации по следующим формулам:
- для титрования слабой кислоты сильным основанием:
![]()
- для титрования слабого основания сильной кислотой:
![]()
• для титрования солей, образованных сильными основаниями и слабыми кислотами:
![]()
где рH — отрицательный десятичный логарифм константы ионизации;
С — концентрация соля или кислоты, образующихся в конце титрования, моль/л.
Таким образом, при титровании смесей слабых кислот или оснований, или солей возможно последовательное — ступенчатое — титрование с использованием различных индикаторов при наличии 2 резких скачков pH. Такое раздельное титрование возможно, если отношение величин констант диссоциации компонентов смеси не меньше 103 — 104. Если эго отношение меньше, ступенчатое титрование невозможно.
При выборе индикаторов для последовательного титрования необходимо учитывать вклад каждого компонента в суммарную величину pH раствора.
При кислотно-основном титровании смесей веществ, близких по свойствам, эквивалентную точку лучше устанавливать потенциометрически (индикаторный электрод — стеклянный; электрод сравнения — каломельный или хлор-серебряный).
Установление точки эквивалентности с помощью потенциометра дает возможность с большей точностью и воспроизводимостью, чем индикаторное титрование, анализировать лекарственные веществ; в сильно окрашенных жидкостях (например, определять соли алкалоидов и азотистых оснований в присутствии метиленового синего), исключать индикаторную ошибку, особенно при титровании разбавленных растворов.
Кривая потенциометрического титрования, позволяющая судить о ходе изменения pH в процессе титрования, может быть использована и при подборе индикаторов для определения ингредиентов смеси, особенно если в одной пробе проводят титрование по разным индикаторам. Зная величины pH, соответствующие эквивалентным точкам для каждого вещества, легко подобрать кислотно-основной индикатор.
Большие возможности в определении близких по химическим свойствам веществ дает метод кислотно-основного титрования в среде неводных растворителей. С помощью дифференцирующих растворителей (кислота уксусная ледяная, ангидрид уксусный, диметилформамид и их смеси с хлороформом, диоксаном, бензолом) можно добиться значительного различия в кислотно-основных свойствах веществ, титруемых вместе. Изменение величин констант ионизации анализируемых веществ с помощью неводных растворителей позволяет потенциометрически фиксировать конец титрования каждого из веществ без разделения смеси на составные компоненты.
Определение смесей кислот
Большинство лекарственных веществ, относящихся к кислотам, являются слабыми кислотами.
При титрований слабых кислот стандартными растворами щелочей образуются соли, подвергающиеся гидролизу, в результате чего получаются растворы со значением pH > 7.
Выбор индикатора, изменяющего цвет вблизи точки эквивалентности, определяется значением pH раствора соли, образующейся при титровании,
Пропись 25 является примером смеси лекарственных веществ, обладающих в разной степени выраженными кислотными свойствами.
Пропись 25.
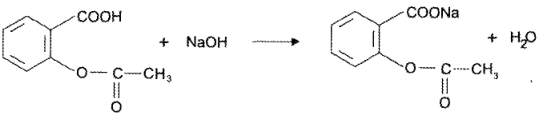
Кислоты ацетилсалициловой 0,3 г
Фенобарбитала 0,05 г.
Кислота ацетилсалициловая как вещество, обладающее более сильными кислотными свойствами (рКа = 3,48), титруется раствором щелочи первой (см. рисунок):
Фенобарбитал имеет значение рКs = 7,43. Значение pH в 1-й точке эквивалентности вычисляют по формуле:
![]()
Этой величине pH соответствует индикатор метиловый красный (интервал изменения окраски 4,2—6,3).
Для определения 2-й точки эквивалентности (соответствующей фенобарбиталу) необходимо рассчитать значение pH раствора натриевой соли фенобарбитала, образующейся в результате 2-го титрования (см. рисунок):
Такой расчет возможен только по конкретной методике.
Методика. 0,2 г порошка растворяют в 10 мл нейтрализованного по тимолфталеину спирта и титруют 0,1 н. раствором натрия гидроксида, а затем титруют с индикатором метиловым красным до желтого окрашивания.
pH раствора натриевой соли фенобарбитала вычисляют по формуле:
![]()
Для определения концентрации натриевой соли фенобарбитала необходимо сделать дополнительные расчеты:
— определить теоретический объем 0,1 н. раствора натрия гидроксида, эквивалентный количеству кислоты ацетилсалициловой:

— определить теоретический объем 0,1 и. раствора натрия гидроксида, эквивалентный количеству фенобарбитала:

Теоретический расчет показывает, что на связывание кислоты ацетилсалициловой и фенобарбитала должно расходоваться 9,51 мл (на 1-е титрование) и 1,23 мл (на 2-е титрование) 0,1 и. раствора натрия гидроксида. Общий объем раствора после титрования составит — 20,74 мл (9,51 + 10 + 1,23 мл). Отсюда молярную концентрацию натриевой соли фенобарбитала рассчитывают следующим образом:

Этой величине pH соответствует индикатор тимолфталеин (интервал изменения окраски 9,3 — 10,5).
Методика.
Кислота ацетилсалициловая. 0,2 г порошка растворяют в 10 мл 95% спирта, прибавляют 5—6 капель раствора метилового красного и титруют 0,1 н. раствором натрия гидроксида до желтого окрашивания.
1 мл 0,1 и. раствора натрия гидроксида соответствует 0,018016 г С9Н8О4 (кислоты ацетилсалициловой):
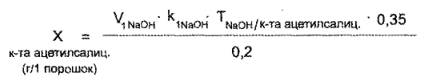
где V1 — объем 0,1 н. раствора натрия гидроксида, пошедший на титрование кислоты ацетилсалициловой по индикатору метиловому красному.
Фенобарбитал. К оттитрованному раствору прибавляют 2—3 ками раствора тимолфталеина и титруют 0,1 и. раствором натрия гидроксида до появления синего окрашивания.
1 мл 0,1 н. раствора натрия гидроксида соответствует 0,02322 г С12Н12N2O3(фенобарбитала).
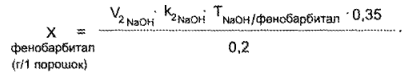
где V2 — объем 0,1 н. раствора натрия гидроксида, пошедший на титрование фенобарбитала по тимолфталеину.
Определение смесей оснований
Органические основания, применяющиеся в медицине, представляют собой слабые основания. При титровании слабых оснований растворами сильных минеральных кислот образуются гидролизующиеся соли, pH растворов которых < 7. Выбор индикатора для фиксирования конечной точки титрования определяется значением pH раствора соли, образующейся при титровании.
При расчете pH следует учесть, что для оснований приводят значение рКь которое связано с рКа соотношением:
![]()
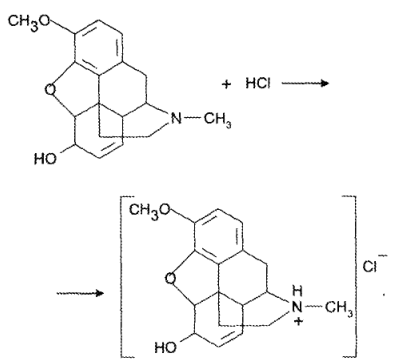
Рассмотрим титрование смеси лекарственных веществ, обладающих основными свойствами, на примере прописи 26, содержащей кодеин и амидопирин.
Пропись 26.
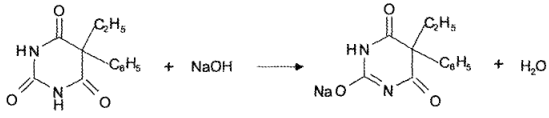
Кодеина 0,015
Амидопирина 0,25.
Кодеин как более сильное основание (рКb = 6,05) титруется стандартным раствором кислоты первым (см. рисунок):
Значение pH в 1-й точке эквивалентности рассчитывают но формуле:
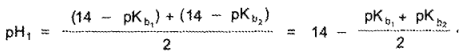
где рКb1 — значение рКb кодеина, равное 6,05;
рКb2 — значение рКb амидопирина, равное 9,0.
Этой величине pH соответствует область изменения окраски индикатора бромтимолового синего (6,0—7,6).
Для определения 2-й точки эквивалентности (при титровании амидопирина) необходимо рассчитать pH раствора образующегося гидрохлорида амидопирина по реакции (см. рисунок):
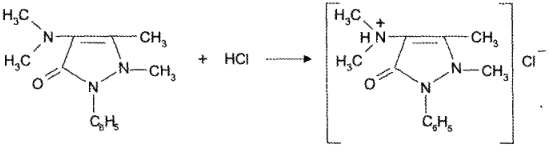
Определение значения pH проводят на основе методики: 0,05 г порошка растворяют в 1 мл спирта, добавляют 5 мл воды и титруют кодеин 0,01 я., а амидопирин — 0,1 н. раствором кислоты хлороводородной.
pH раствора гидрохлорида амидопирина вычисляют по формуле:
![]()
Для определения концентрации гидрохлорида амидопирина необходимо сделать дополнительные расчеты:
— определить теоретический объем 0,01н. раствора кислоты хлороводородной, эквивалентный количеству кодеина:

— определить теоретический объем 0,1 н, раствора кислоты хлороводородной, эквивалентный количеству амидопирина:

Теоретический расчет показывает, что на титрование кодеина и амидопирина должно быть израсходовано 0,88 мл 0.01н, раствора кислоты хлороводородной и 2,04 мл 0,1 н. раствора кислоты хлороводородной. Обший объем раствора после титрования составит 8,92 мл (0,88 + 2,04 + 1,0 + 5,0). Отсюда молярную концентрацию гидрохлорида амидопирина можно вычислить следующим образом:

Значение pH в точке эквивалентности при титровании амидопирина попадает в интервал перехода окраски индикатора бромфенолового синего (pH 3,0 — 4,6).
Методика. Кодеин. 0,05 г порошка растворяют в 1 мл спирта, прибавляют 1—2 капли раствора бромфенолового синего, 5 мл воды до ясного синего окрашивания и титруют 0,0 !н. раствором кислоты хлороводородной до появления желтого с зеленоватым опенком окрашивания.
1мл 0,01н. раствора кислоты хлороводородной соответствует 0,003174 г С18Н21NО3 * Н2О (кодеина).
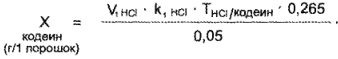
Амидопирин. К оттитрованной жидкости прибавляют 3 — 4 капли раствора бромфенолового синего до фиолетового окрашивания раствора и титруют 0,1 я. раствором кислоты хлороводородной до появления золотисто-желтого окрашивания.
I мл 0,1 н. раствора кислоты хлороводородной соответствует 0,02313 г С13Н17N2О (амидопирина).