Глава 9. Анализ производных фенолов, хинонов, ароматических кислот, фенолокислот, ароматических аминокислот и их производных
Фармацевтическая химия — Арзамасцев А. П. — 2004
- Лекарственные вещества группы фенолов
- Производные n- аминофенола, хинона и тетрациклины
- Ароматические кислоты и аминокислоты
- Ароматические кислоты и их производные
- Амиды салициловой кислоты. Эфиры кислоты салициловой
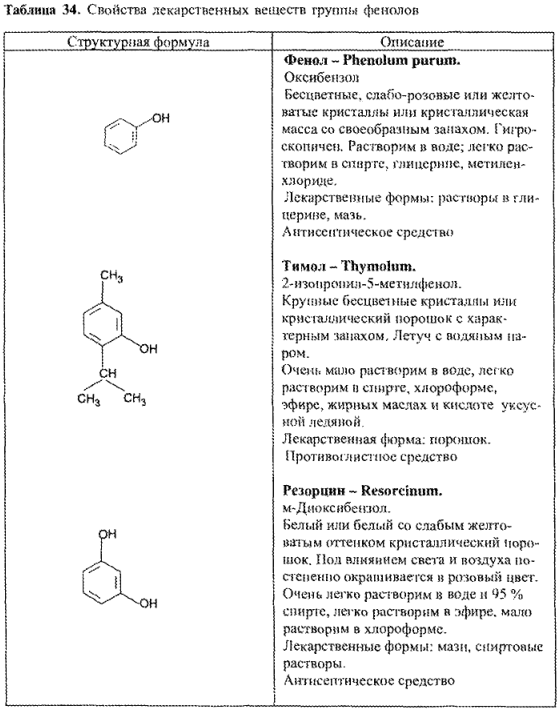
ЛЕКАРСТВЕННЫЕ ВЕЩЕСТВА ГРУППЫ ФЕНОЛОВ
Фенолы можно рассматривать как ароматические спирты, у которых одна или несколько гидроксильных групп связаны непосредственно с ароматическим ядром. Этим обусловлены главные отличия фенолов от алифатических спиртов.
Простые фенолы, т.е. вещества, не содержащие в молекуле никаких функциональных групп, кроме ароматического ядра и одного или более фенольных гидроксилов (оксибензол, резорцин, тимол), применяют в качестве антисептических средств. Среди лекарственных веществ гомологом фенола (оксибензола) является –тимол. К производным фенолов (по химической классификации) можно отнести синтетические аналоги эстрогенов нестероидной структуры – гексэстрол (синэстрол), диэтилстильбэстрол. Один или несколько фенольных гидроксилов содержатся в лекарственных веществах как природного, так и синтетического происхождения с различным фармакологическим действием (морфина гидрохлорид, рутозид, синэстрол. Пиридоксина гидрохлорид и др.).
Общие свойства лекарственных веществ группы фенолов приведены в табл. 34.

Химические свойства и анализ качества
Фенолы проявляют значительно большую кислотность, чем спирты и вода, однако они слабее угольной и карбоновых кислот, не окрашивают лакмус.
Значения рКа следующие: фенол — 9,89, уксусная кислота – 4,76, угольная кислота — 6,12.
Кислотность определяется наличием в структуре фенольного гидроксила и образованием соответствующего аниона:

Чем стабильнее анион, тем сильнее кислота.
Внутри данной группы кислотность различна и зависит от заместителей, количества гидроксильных групп.
Фенолы хорошо растворяются в водных растворах щелочей с образованием фенолятов, однако данную реакцию нельзя использовать для количественного определения из-за гидролиза образующейся соли.
Фенолы не взаимодействуют с гидрокарбонатами щелочных металлов, потому что слабее угольной кислоты и не могут вытеснять ее. По реакции взаимодействия с гидрокарбонатами щелочных металлов различаются фенолы и карбоновые кислоты.
Характерной качественной реакцией на фенолы является образование окрашенных комплексов [Fe(OR)6]3- с солями трехвалентного железа. Окраска зависит от количества гидроксильных групп, их расположения, наличия других функциональных групп (табл. 35).

Комплекс неустойчив, разрушается при действии на него органических и минеральных кислот.
Реакция используется, кроме определения подлинности, и при анализе чистоты. Так, примесь пирокатехина в резорцине определяется по реакции осаждения с ацетатом свинца, а примесь фенола в тимоле — по окраске с железа (III) хлоридом.
Образование сложных эфиров
При фармацевтическом качественном и количественном анализе часто используются реакции ацетилирования. Образующийся сложный эфир идентифицируется по характерной Тпл:


Количественное определение синэстрола и диэтилстильбэстрола проводится методом ацетилирования.
Восстановительные свойства
Фенолы легко окисляются лаже кислородом воздуха, поэтому при их хранении возможно появление оттенков (розового, желтого, бурого).
Двухатомные фенолы окисляются быстрее, чем одноатомные. Скорость окисления зависит также от pH среды, В щелочной среде окисление идет быстрее. Вследствие легкости окисления фармакопея вводит показатель: цветность.
Реакция окисления фенолов протекает сложно, и характер продуктов во многом зависит от природы заместителей.
Схему окисления фенола можно представить таким образом:

о-Бензохинон
Резорцин окисляется с образованием сложной смеси продуктов, но без м-хинонов.
На способности препаратов окисляться основана такая реакция подлинности, как индофеноловая проба. В качестве окислителя используют хлорную известь, хлорамин, бромную воду:

Образующийся индофенол амфотерного характера и может образовывать хорошо диссоциируемые соли как с кислотами, так и с основаниями. Соли имеют различную окраску (табл. 36):


Реакции идут легко, если о- и n-положения не заняты.
Реакции электрофильного замещения
Гидроксильная группа, связанная с ароматическим ядром, 8 щелочном растворе – сильнейший орто- и пара-ориентант. В связи с этим для фенолов легко проходят реакции галогенирования, нит- розирования, нитрования и др.
Галогенирование
Бромирование и йодирование широко применяются при анализе фенолов. Образование трибромфенола в виде осадка используется для подтверждения подлинности фенола:

При избытке бромной воды образуется желтого цвета 2,4,4,6- тетра-бромциклогексадиен-2,5-он:

Наиболее легко идет галогенирование фенолов в щелочной среде, но в сильнощелочной среде происходит окисление фенола. Резорцин бронируется в кислой среде, образуя трибромрезорцин, который в воде растворим. Если одно из положений занято (как у тимола), образуется дибромпроизводное:

Реакции галогенирования используются также для количественного определения фенолов.
Нитрозирование (нитрозореакция Либермана)
Реакция нитрозирования является разновидностью индофеноловой реакции:

Нитрозогруппа усиливает подвижность водорода у фенольного гидроксила, происходит изомеризация. Образующийся хиноноксим конденсируется с фенолом:

Данные об окраске образующихся при нитрозореакции Либермана индофенолов представлены в табл. 37.

Нитрование
Фенолы нитруются кислотой азотной, разбавленной при комнатной температуре, с образованием о- и n-нитрофенола:

Добавление раствора натрия гидроксида усиливает окраску вследствие образования хорошо диссоциируемой соли:

Реакция сочетания фенолов с солью диазония в щелочной среде
Фенолы легко вступают в реакцию замещения с солями диазония в щелочной среде с образованием азокрасителей, имеющих в указанной среде окраску от оранжевой до вишнево-красной:

Это общая реакция на фенолы, не имеющие заместителей в орто- и пара-положении. Легче сочетание происходит в пара-положении из-за образования длинной цепи сопряженных связей.
Соль диазония из-за нестойкости готовят непосредственно перед проведением реакции, используя соединения с первичной ароматической аминогруппой:

При образовании азокрасителя pH среды не должна быть выше 9,0—10,0, так как в сильнощелочной среде соль диазония образует не способный к азосочетаиию диазогидрат:

Реакции окисления и конденсации
Эти реакции широко используются в анализе для подтверждения подлинности как открытого, так и заблокированного фенольного гидроксила.
Образование арилметановых красителей происходит при конденсации фенолов с альдегидами, ангидридами кислот, кетонами:

Для тимола предлагается реакция конденсации с хлороформом в щелочной среде. Продукт реакции окрашен в красно-фиолетовый цвет:

Для фенолов со свободным п-положением характерна реакция конденсации с 2,6-дихлорхинонхлоримидом, при этом образуется индофенол:

Образование производного индофенола возможно при нитровании тимола в среде уксусного ангидрида и концентрированной серной кислоты:

Часто используются реакции конденсации фенолов с лактонами (фталевый ангидрид). С фенолом продукт конденсации называется фенолфталеином и используется как индикатор, имеющий в щелочной среде малиновую окраску:

С тимолом образуется тимолфталеин ~ индикатор, окрашенный в щелочной среде в синий цвет:

Резорцин сплавляют в фарфоровом тигле с избытком фталевого ангидрида в присутствии нескольких капель концентрированной Н2SО4. Полученный плав желто-красного цвета после охлаждения выливают в разбавленный раствор щелочи. Появляется интенсивно-зеленая флюоресценция образующегося в результате реакции флюоресценна:

Анализ чистоты
В резорцине определяют примесь пирокатехина по реакции с аммония молибдатом. При наличии примеси появляется окраска, интенсивность которой сравнивают с эталонной.
Другая примесь в препарате резорцина – фенол. Примесь фенола определяют по запаху, для этого препарат с небольшим количеством воды нагревают на водяной бане при температуре 40—50 °С.
В тимоле определяют примесь фенола по реакции с железа (III) хлоридом. По условию методики ГФ концентрация тимола вследствие малой его растворимости составляет 0,085 %. Окраска комплекса тимола с железа хлоридом при такой концентрации не воспринимается, а при наличии примеси фенола появляется фиолетовая окраска. Примесь фенола в препарате недопустима.
Количественное определение
Для количественного определения фенолов используется броматометрия: как прямой (тимол), гак и обратный (фенол, резорнин, синэстрол) способ, В склянку с притертой пробкой помещают препарат, избыток титрованного раствора калия бромата и калия бромида. Подкисляют серной кислотой:
![]()
Выделившийся в результате реакции бром идет на галогенирование фенола:

Реакция протекает в течение 10—15 мин; на это время склянку оставляют в темном месте. Затем к смеси прибавляют раствор калия иодида и оставляют еще на 5 мин:
![]()
Прямое, титрование принято ГФ для количественного определения тимола. В прямом титровании избыточная капля йода изменяет окраску индикаторов (метилового оранжевого, метилового красного), В обратном титровании выделившийся йод оттитровывают раствором тиосульфата натрия. Индикатор — крахмал.
Следует помнить, что на процесс бромирования влияют условия определения: длительность реакции, концентрация кислоты.
Молярная масса эквивалентов, обозначаемая как М(1/z) следующая:

В обратном способе обязательно проводят контрольный опыт.
Ацетилирование применяется для количественного определения синэстрола и диэтилстильбэстрола, Навеску препарата помещают в колбу с избытком уксусного ангидрида и нагревают в течение 45 мин в присутствии пиридина (реакцию — см, выше). Затем в реакционную среду добавляют воду, непрореагировавший уксусный ангидрид гидролизуется. Уксусную кислоту оттитровывают стандартным раствором натрия гидроксида:

Проводят контрольный опыт, М(1/z)= ½ М препарата.
