Методы исследования структуры белков и пептидов
Аминокислоты, соединяясь пептидной связью, образуют полипептидные цепи. Линейная последовательность аминокислотных остатков, соединенных между собой пептидными связями, определяет первичную структуру белковой молекулы.
ЭТАПЫ ИССЛЕДОВАНИЯ ПЕРВИЧНОЙ СТРУКТУРЫ БЕЛКОВ И ПЕПТИДОВ
I. Выделение белка из смеси в чистом виде (по одному из признаков: размер молекулы, заряд, специфическое сродство связывания). Определение М.
II. Определение N-концевой аминокислоты.
III. Определение С-концевой аминокислоты.
IV. Определение аминокислотной последовательности белковой цепи.
Выделение белка из биологического материала основано на его физико-химических свойствах. Чаще всего для этих целей используют кислотно-основные свойства белков (амфотерность, заряд молекулы, изоэлектрическое состояние).
От заряда белковых молекул зависит их:
- растворимость (минимальна в ИЗС);
- электрофоретическая подвижность;
- структура и биологическая активность.
При растворении в водной среде на поверхности белковой молекулы формируется гидратная оболочка.
Устойчивость белка в растворе зависит от:
-
- заряда белковой молекуы;
- наличия гидратной оболочки;
- молекулярной массы белка.
Для выделения нативных белков (без изменения пространственной структуры) из биологического раствора используют методы:
-
-
- высаливание (осаждение солями щелочноземельных металлов: хлорид натрия, сульфат аммония); не нарушается первичная структура белка;
- осаждение (использование водоотнимающих веществ: спирт или ацетон при низких температурах, около –20С).
-
При использовании этих методов белки лишаются гидратной оболочки и выпадают в осадок в растворе.
Денатурация — нарушение пространственной структуры белков (первичная структура молекулы сохраняется). Может быть обратимая (структура белка восстанавливается после устранения денатурирующего агента) или необратимая (пространственная структура молекулы не восстанавливается, например, при осаждении белков минеральными концентрированными кислотами, солями тяжелых металлов).
МЕТОДЫ РАЗДЕЛЕНИЯ БЕЛКОВ
Отделение белков от низкомолекулярных примесей
Метод мембранных сит (диализ)
Используют диализную мембрану, которая является полимером и имеет поры определенной величины. Малые молекулы (низкомолекулярные примеси) проходят через поры в мембране, а крупные (белки) задерживаются. Таким образом белки отмывают от примесей.
Разделение белков по молекулярной массе
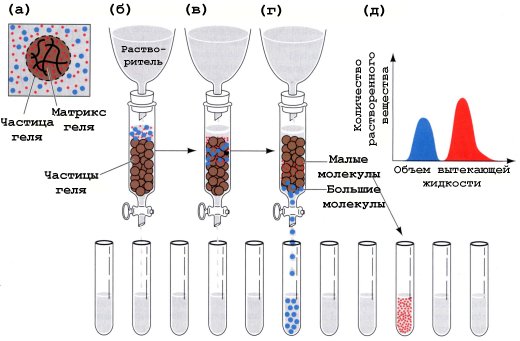
Гель-хроматография
Хроматографическую колонку заполняют гранулами геля (сефадекс), который имеет поры определенной величины. В колонку вносят смесь белков. Белки, размер которых меньше, чем размер пор сефадекса, задерживаются в колонке, так как «застревают» в порах, а остальные свободно выходят из колонки. Размер белка зависит от его молекулярной массы.
Ультрацентрифугирование
Этот метод основан на различной скорости седиментации (осаждения) белковых молекул в растворах с различным градиентом плотности (сахарозный буфер или хлорид цезия).

Электрофорез
Данный метод основан на различной скорости миграции белков и пептидов в электрическом поле в зависимости от заряда.
Носителями для электрофореза могут служить гели, ацетатцеллюлоза, агар. Разделяемые молекулы движутся в геле в зависимости от размера: те из них, которые имеют большие размеры, будут задерживаться при прохождении через поры геля. Меньшие молекулы будут встречать меньшее сопротивление и, соответственно, двигаться быстрее. В результате, после проведения электрофореза, большие молекулы будут находиться ближе к старту, чем меньшие.
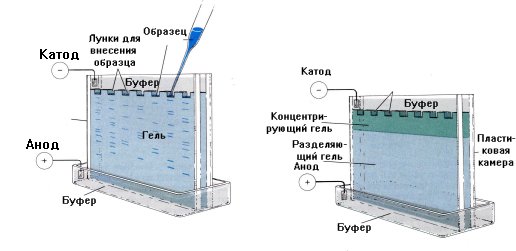
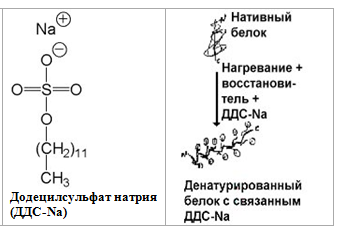
Методом электрофореза можно разделить белки по молекулярной массе. Для этого используют электрофорез в ПААГ в присутствии додецилсульфата натрия (ДДS-Na).
ДДС-Na является дифильным веществом и содержит заряженную группу и гидрофобную. Белки связываются с ДДС-Na своими гидрофобными радикалами и при этом денатурируют. Таким образом, белки выравниваются по форме и заряду. После этого подвижность белка при электрофорезе зависит только от его молекулярной массы.
Выделение индивидуальных белков
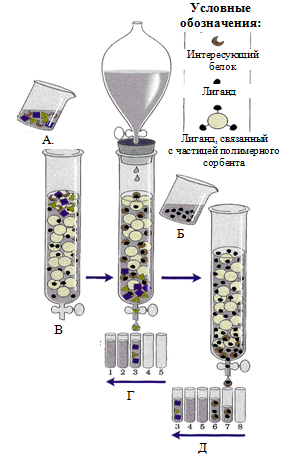
Аффинная хроматография
Метод основан на способности белков прочно связываться с различными молекулами нековалентными связями. Используется для выделения и очистки ферментов, иммуноглобулинов, рецепторных белков.
Молекулы веществ (лиманды), с которыми специфически связываются определенные белки, ковалентно соединяют с частицами инертного вещества. Смесь белков вносят в колонку и искомый белок прочно присоединяется к лиганду. Остальные белки свободно выходят из колонки. Задержанный белок затем можно вымыть из колонки с помощью буферного раствора, содержащего в свободном состоянии лиганд. Этот высокочувствительный метод позволяет выделить в чистом виде очень малые количества белка из клеточного экстракта, содержащего сотни других белков.
Изоэлектрофокусирование
Используется пластина с амфолином — веществом, у которого заранее сформирован градиент pH. Проводят сначала электрофорез в горизонтальном направлении. Белки разделяются в зависимости от заряда (изоэлектрическая точка). Затем обрабатывают пластину раствором ДДС-Na и проводят электрофорез в вертикальном направлении. Белки разделяются в зависимости от молекулярной массы.
Анализ гомологичных белков
Гомологичные белки — белки, которые выполняют одну и ту же функцию, но различаются по первичной структуре (например, локализованы в различных органах или образуются при патологических состояниях). Например, HbA (содержит Glu) HbS (содержит Val) при серповидноклеточной анемии.
Метод пептидных карт (отпечатков пальцев), предложенный Ингремом.
Этапы:
- оба анализируемых белка расщепляют на фрагменты (пептиды);
- смесь пептидов каждого белка наносят в виде пятна на угол листа хроматографической бумаги;
- проводят электрофорез в горизонтальном направлении;
- проводят распределительную хроматографию в вертикальном направлении;
- полученные карты окрашивают и сравнивают;
- различающиеся пептидные пятна выделяют и анализируют.
УСТАНОВЛЕНИЕ АК-ПОСЛЕДОВАТЕЛЬНОСТИ БЕЛКА
I. Определение N-концевой АК
1. Метод Сэнжера (ФДНБ — фтординитробензол — связывается с N-концевой АК с образованием соединения желтого цвета).
2. Метод Эдмана (используется ФИТЦ — фенилизотиоцианат, который также связывается с N-концевой АК с образованием соединения оранжевого цвета).
3. Взаимодействие N-концевой АК с дансилхлоридом с образованием флуоресцирующего соединения.
4. Ферментативный метод (использование аминопептидаз — это ферменты которые избирательно отщепляют N-концевые АК, например, аланиновая аминопептидаза).
II. Определение С-концевой АК
1. Метод Акабори (гидразин разрушает все пептидные связи и реагирует со всеми АК, кроме концевой; концевую АК определяют после обработки смеси ФДНБ).
2. Ферментативный метод (карбоксипептидазы А отщепляют ароматические С-конце-вые АК, карбоксипептидазы В — основные С-концевые АК).
III. Определение АК-последовательности
1. Используют прибор секвенатор, предложенный Эдманом.
2. Избирательный гидролиз.
